

Por ejemplo,
Zn(s) + CuSO4(ac) → Cu(s) + ZnSO4(ac)
El zinc más activo que el cobre, lo desplaza y el cobre queda elemental. El grupo que acompaña al cobre en el compuesto (SO42-) no sufre modificación alguna. Ahora tenemos el compuesto pero de zinc.
La tabla de actividad de los metales se presenta a continuación:
Figura 1.

Fuente: Tomada y adaptada de Chemistry. The Central Science (9a Ed) por Brown, New Jersey: Pearson, Prentice Hall. Derechos de autor, 2002.
(Para ampliar la imagen haga clic sobre ella)
Desde la tabla de actividad se puede revisar si la reacción ocurre o no. En el caso anterior el zinc es más activo que el cobre y por esto lo desplaza desde el sulfato de cobre (II).
Solo se necesita que un elemento más arriba de la tabla desplace a otro en posición baja de la tabla. El elemento más activo es el litio, el cual desplaza a los demás en sus compuestos solubles.
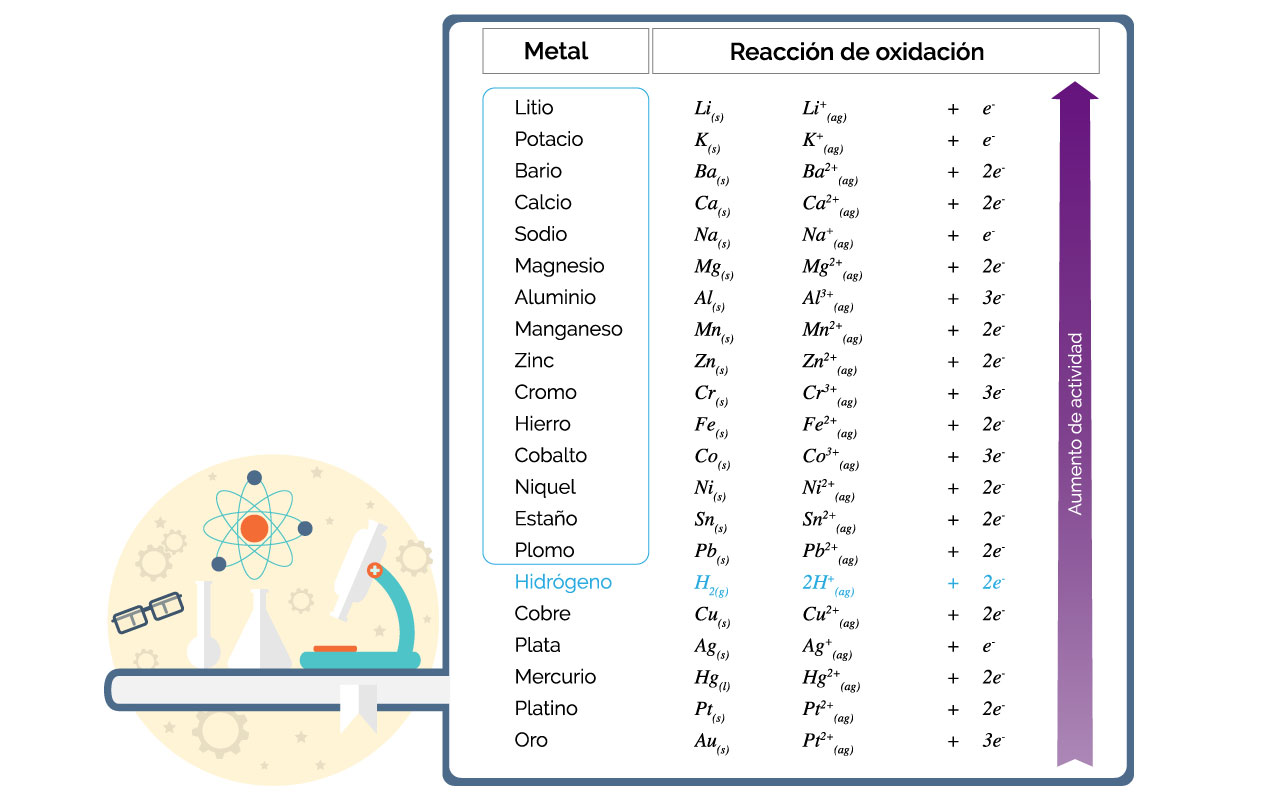
Todos los elementos metálicos por encima del hidrógeno lo desplazan de los ácidos no oxidantes. Los ácidos no oxidantes son: HCl(ac), HBr(ac), HI(ac), HF(ac), H2S(ac) y H2SO4(ac) diluido. En la siguiente tabla se presentan los metales enmarcados en azul.
Figura 2.
Fuente: Tomada y adaptada de Chemistry. The Central Science (9a Ed) por Brown, New Jersey: Pearson, Prentice Hall. Derechos de autor, 2002.
(Para ampliar la imagen haga clic sobre ella)
Desde el plomo (lead) hasta el litio desplazan al hidrógeno de los ácidos no oxidantes. A continuación se presenta una reacción típica de desplazamiento de hidrógeno de un ácido no oxidante por un metal más activo.
2Cr(s) + 3H2SO4(ac) → Cr2(SO4)3(ac) + 3H2(g)↑
En la ecuación la flecha ↑ en el hidrógeno indica que se desprende como gas de la mezcla. Durante la reacción se observa una efervescencia o burbujeo debido al hidrógeno gaseoso. Además, se produce Cr2(SO4)3 como compuesto o sal soluble.
Todos los elementos metálicos a partir del hierro desplazan al hidrógeno del vapor de agua o agua en estado gaseoso. En la siguiente tabla se presentan dichos los metales enmarcados en verde.
Figura 2.

Fuente: Tomada y adaptada de Chemistry. The Central Science (9a Ed) por Brown, New Jersey: Pearson, Prentice Hall. Derechos de autor, 2002.
(Para ampliar la imagen haga clic sobre ella)
A continuación se presenta una reacción típica de desplazamiento de hidrógeno del vapor de agua, por un metal más activo.
Mg(s) + 2H2O(V) → Mg(OH)2(s) + 3H2(g)↑
En la ecuación la flecha ↑ en el hidrógeno indica que se desprende como gas de la mezcla. Durante la reacción se observa una efervescencia o burbujeo debido al hidrógeno gaseoso. También se produce hidróxido de magnesio [Mg(OH)2]. Del agua solo se desplaza un hidrógeno. El otro hidrógeno acompaña al oxígeno en el hidroxilo (OH-). Esta es otra manera de producir un hidróxido de metal. No todos los metales pueden formar hidróxidos de esta manera o desplazar al hidrógeno, únicamente los elementos del hierro al litio.
Con este caso de desplazamiento se ilustra por qué se deben proteger las estructuras metálicas, por ejemplo de hierro, ya que el agua del ambiente o humedad puede reaccionar con el hierro de la estructura y deteriorarla.
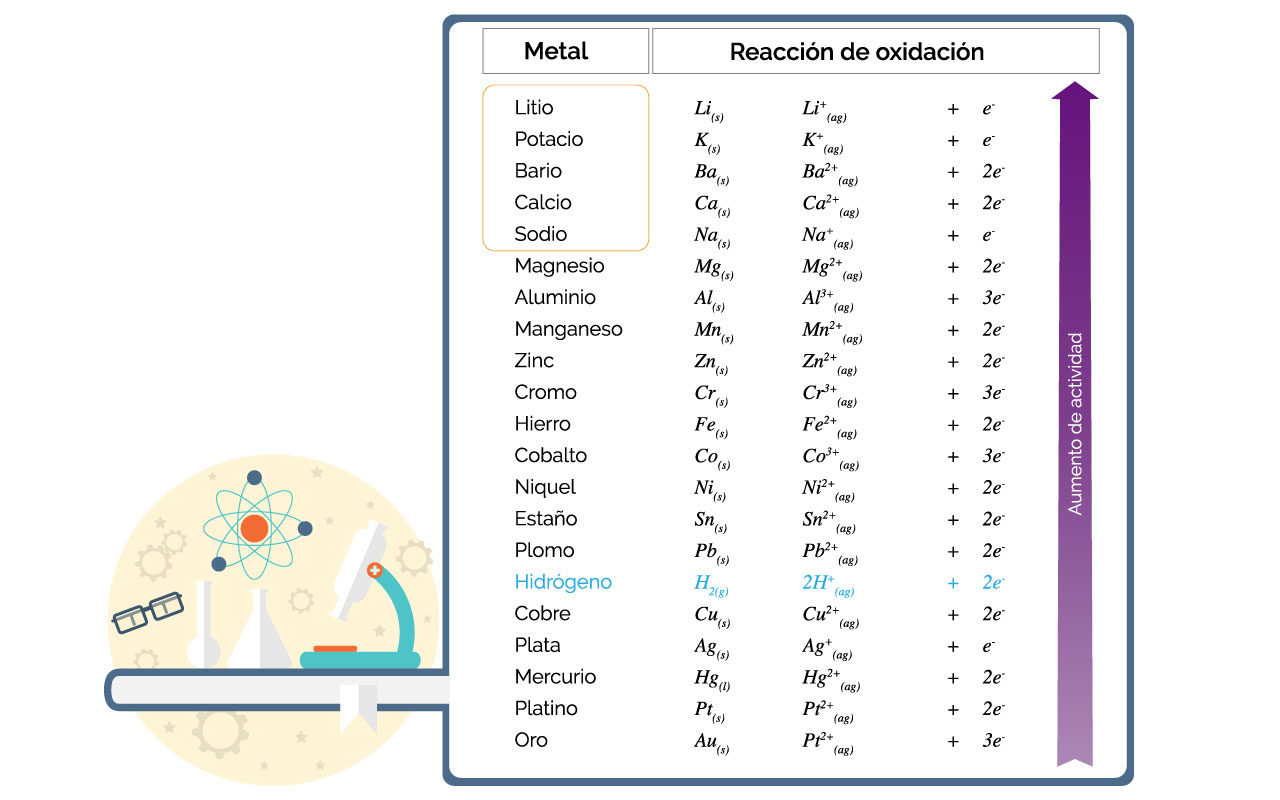
Todos los elementos metálicos a partir del sodio desplazan al hidrógeno del agua líquida. En la siguiente tabla se presentan dichos los metales enmarcados en rojo.
Figura 2.
Fuente: Tomada y adaptada de Chemistry. The Central Science (9a Ed) por Brown, New Jersey: Pearson, Prentice Hall. Derechos de autor, 2002.
(Para ampliar la imagen haga clic sobre ella)
A continuación se presenta una reacción típica de desplazamiento de hidrógeno del agua líquida, por un metal más activo.
2Na(s) + 2H2O(l) → 2NaOH(ac) + 3H2(g)↑
En la ecuación la flecha ↑ en el hidrógeno indica que se desprende como gas de la mezcla. Durante la reacción se observa una efervescencia o burbujeo debido al hidrógeno gaseoso. También se produce hidróxido de sodio (NaOH). Del agua solo se desplaza un hidrógeno. El otro hidrógeno acompaña al oxígeno en el grupo hidroxilo (OH-). Esta es otra manera de producir un hidróxido de metal. No todos los metales pueden formar hidróxidos de esta manera o desplazar al hidrógeno, únicamente los elementos del sodio al litio.
La reacción de los elementos sodio a litio es muy exotérmica, y generalmente explosiva. Cuando se trabaja con estos metales se debe cuidar no tener fuentes de agua cercanas. Los elementos Na, Ca, Ba, K y Li, no se encuentran libres en la naturaleza. Su alta reactividad con ácidos, vapor de agua y agua líquida hace que reaccionen rápidamente hasta dar un compuesto con mayor estabilidad.
A continuación se presenta un ejemplo de desplazamiento entre no metales. Si se burbujea cloro en una solución de bromuro de sodio (NaBr), ocurre lo siguiente:
2NaBr(ac) + Cl2(g) → 2NaCl(ac) + Br2(l)
El cloro desplazó al bromo en el compuesto soluble y se produjo bromo elemental líquido. Es una manera de preparar bromo elemental.
La serie de actividad de los no metales se presenta a continuación:
Serie de actividad F2 > Cl2 > Br2 > I2