

Por ejemplo, se colocan 17 g de NaCl en 100 ml de agua, ¿Qué tipo de solución se tiene?
Esta es la disolución de un sólido en un líquido. La solubilidad del NaCl es 35,8 g /100 mL a 20 °C (358 g/L, a 20 °C).
Colocamos una cantidad menor de NaCl, 17 g, a la máxima cantidad de soluto que puede disolver el agua, 35,8 g. Por lo tanto, el solvente admite disolver más soluto. La clase de solución es insaturada.
Veamos el comportamiento de la solubilidad de un sólido en un líquido con otros factores.
En general, la solubilidad aumenta con aumento de la temperatura para los sólidos [excepción: Ce2(SO4)3], como se pueden inferir de la gráfica 1.
La presión afecta poco la solubilidad de las sustancias sólidas.
Figura 1. Solubilidad de algunas sales.
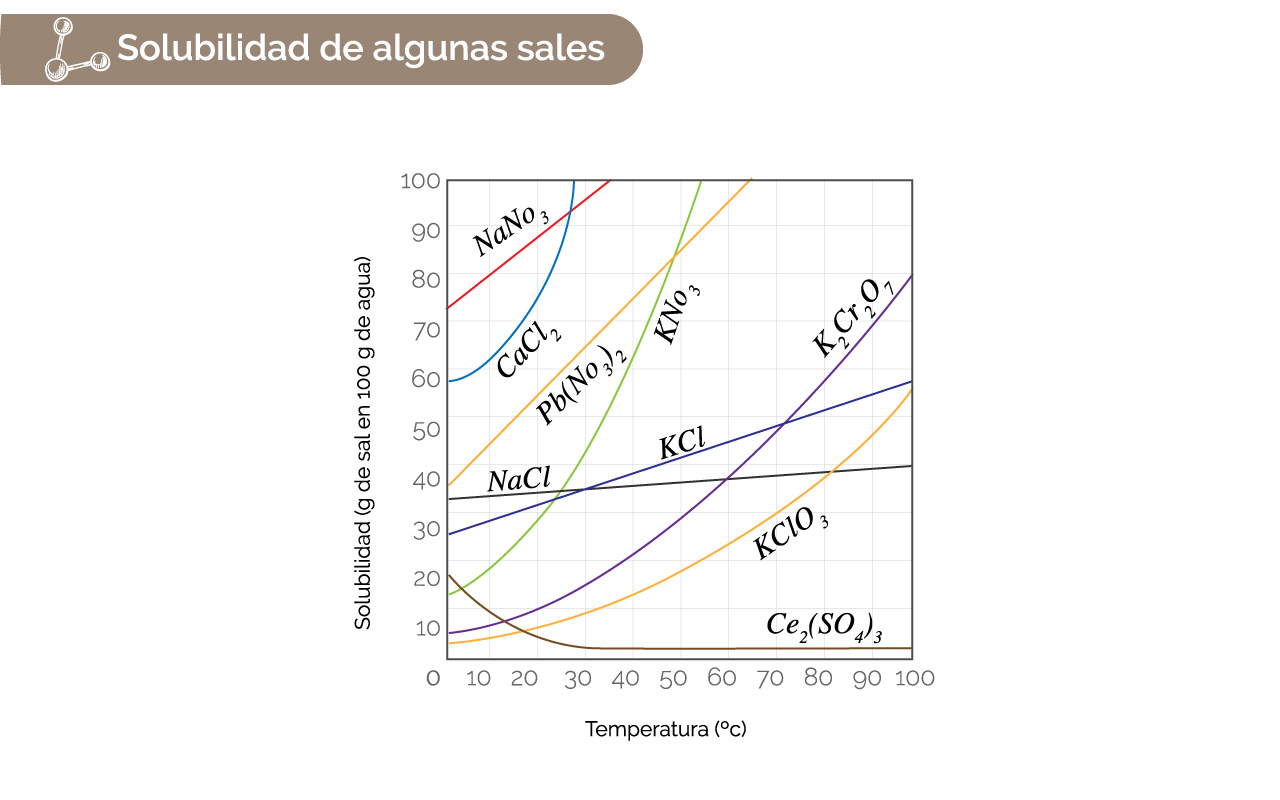
Fuente: Tomada y adaptada de Chemistry. The Central Science (9a Ed) por Brown, New Jersey: Pearson, Prentice Hall. Derechos de autor, 2002.
(Para ampliar la imagen haga clic sobre ella)
El soluto debe ser un líquido miscible (mezclable) y debe ser polar como el H2SO4 o sustancias orgánicas polares de bajo peso molecular.
Las clases de soluto son: con miscibilidad parcial y miscibilidad total. Los líquidos que no se disuelven en agua se les denomina inmiscibles.
El proceso de Solubilización de un líquido en agua siempre es exotérmico.
En general, la solubilidad de un líquido en agua aumenta con el aumento de temperatura.
La presión afecta poco la solubilidad de los líquidos en agua.
Influye la polaridad de las sustancias en la solubilidad de un líquido en otro semejante disuelve a semejante
En la tabla 3 se presenta la solubilidad de algunos alcoholes en agua y hexano (C6H14).
Figura 2. Solubilidad de algunos alcoholes.
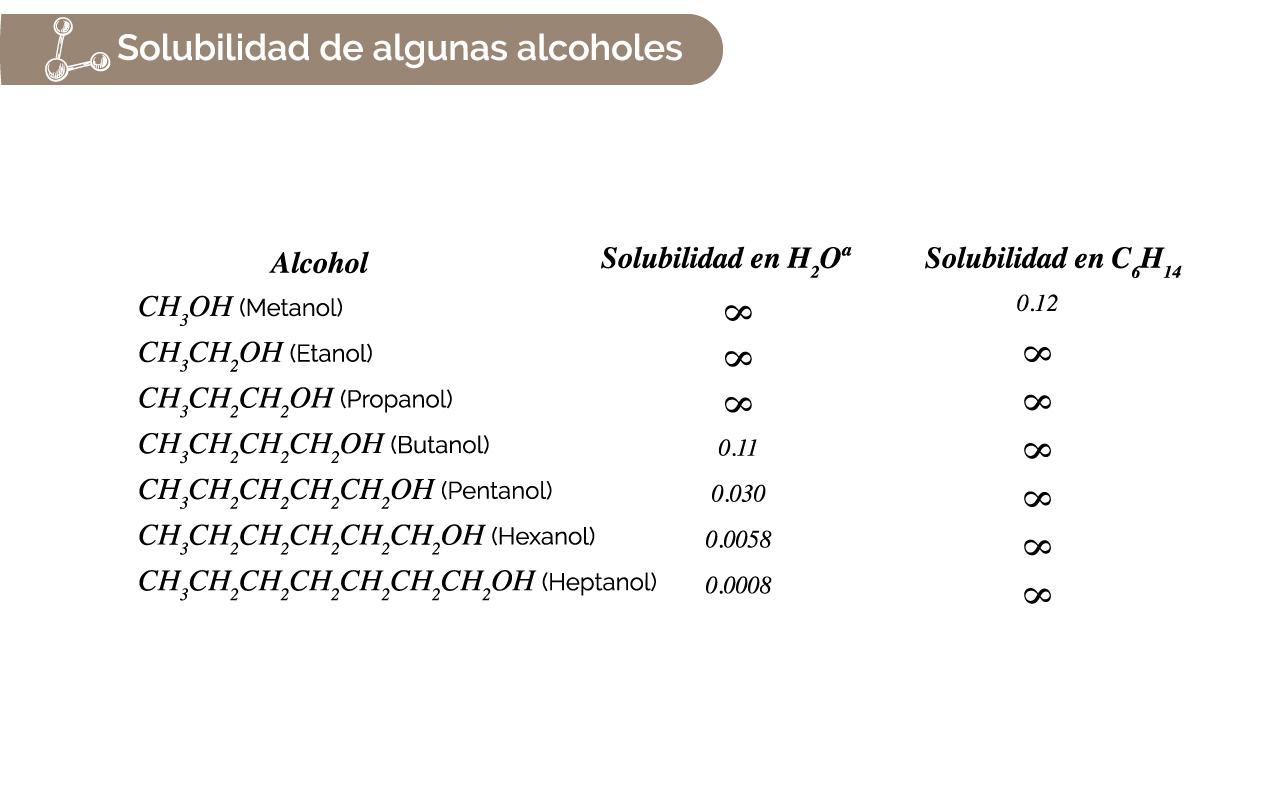
Fuente: Tomada y adaptada de Chemistry. The Central Science (9a Ed) por Brown, New Jersey: Pearson, Prentice Hall. Derechos de autor, 2002.
(Para ampliar la imagen haga clic sobre ella)
Algunos alcoholes presentan solubilidad en agua en todas las proporciones (α) y otros parcialmente como el butanol o pentanol.
El soluto es un gas disuelto y debe ser compuesto polar como HF, HCl, HBr, HI o H2S, ligeramente polares como el O2 o que reaccionan con agua como el CO2.
Las clases de soluciones son: insaturada y saturada.
El proceso de solubilización de un gas en agua es exotérmico.
En general, la solubilidad de un gas en agua disminuye con la temperatura. En la gráfica 2 se tienen valores de solubilidad a diferentes temperaturas para algunos gases conocidos.
Figura 3. Solubilidad de gases.
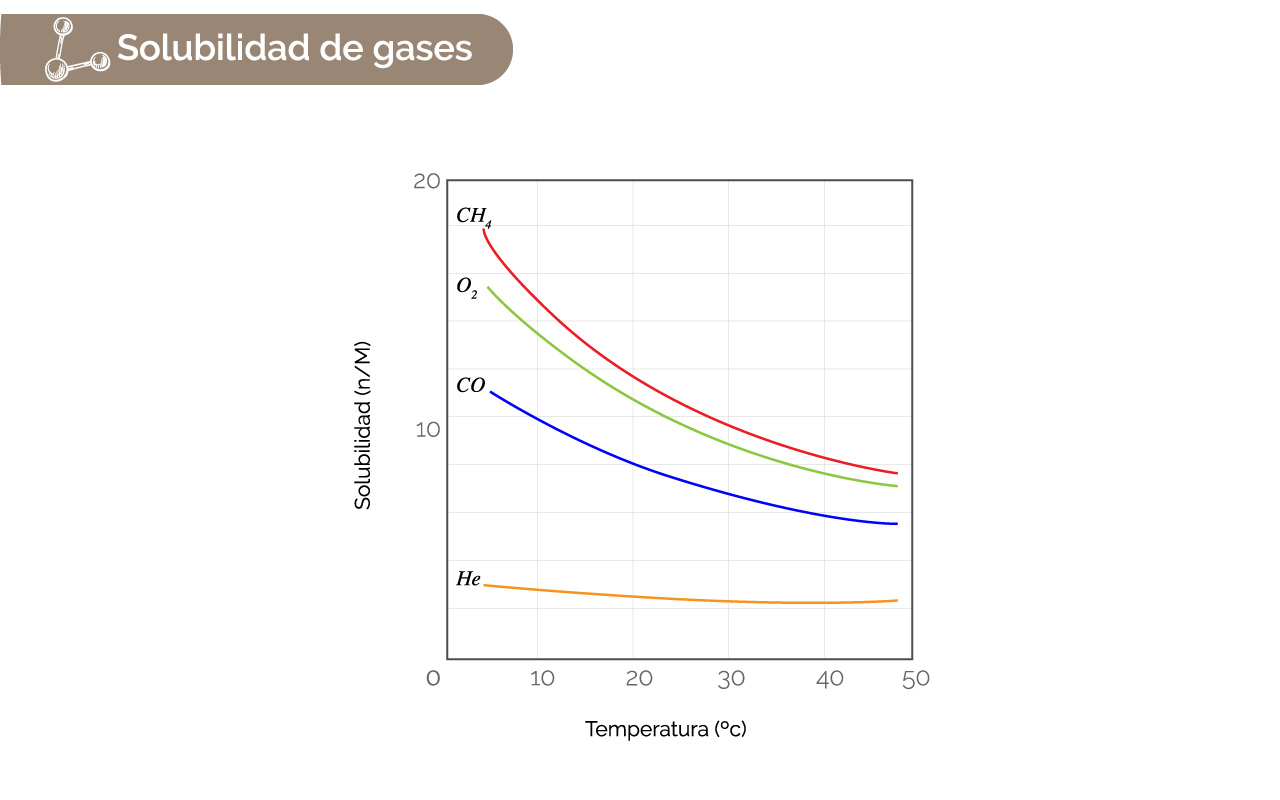
Fuente: Tomada y adaptada de Chemistry. The Central Science (9a Ed) por Brown, New Jersey: Pearson, Prentice Hall. Derechos de autor, 2002.
(Para ampliar la imagen haga clic sobre ella)
El aumento de la presión aumenta la solubilidad de los gases, porque se obliga al gas a disolverse en el solvente. En la figura 1 se puede observar este proceso.
Figura 4. Aumento de la solubilidad de un gas con la presión.
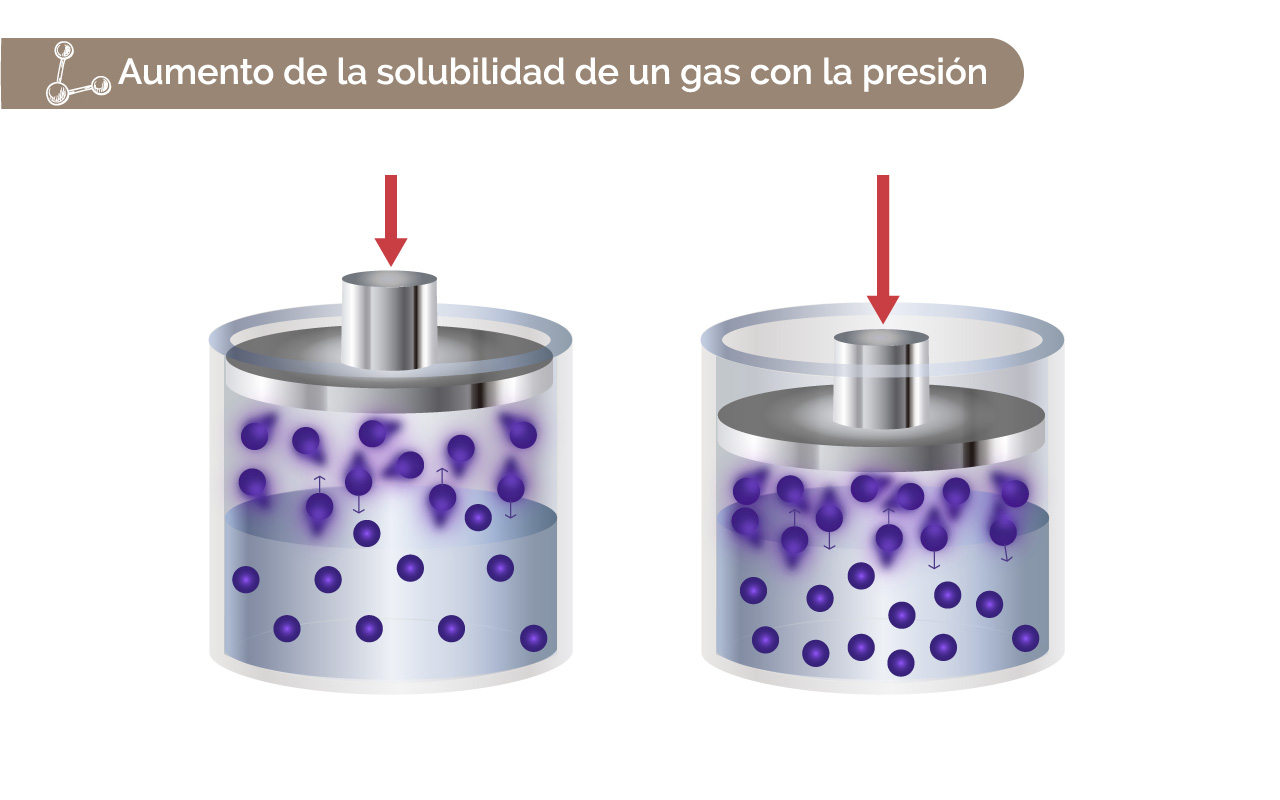
Fuente: Tomada y adaptada de Chemistry. The Central Science (9a Ed) por Brown, New Jersey: Pearson, Prentice Hall. Derechos de autor, 2002.
(Para ampliar la imagen haga clic sobre ella)