Ejemplo de tratamiento de reacciones redox avanzada
Establecer la ecuación iónica total para la reacción de K2Cr2O7 y H2O2, que se lleva a cabo en solución acuosa y pH ácido (H2SO4).
- Hallar las semi – reacciones de oxidación y reducción. Se buscan en las tablas de potenciales estándar de reducción las semi – reacciones para K2Cr2O7 y H2O2. La que presente el mayor potencial estándar de reducción es la que se reduce. A continuación se presenta la tabla 1 de potenciales estándar de reducción.
Figura 1. Potencial estándar de reducción de semi – reacciones. Tomada y adaptada de Chemistry. The Central Science (9a Ed) por Brown, New Jersey: Pearson, Prentice Hall. Derechos de autor, 2002.

Fuente: Tomada y adaptada de: BROWN et al, 2002.
(Para ampliar la imagen haga clic sobre ella)
Las dos semi – reacciones extraídas de la tabla son:
Cr2O72-(ac) + 14H+(ac) + 6e- → 2Cr3+(ac) + 7H2O(l) ; E° = +1,33 V (se reduce)
O2(g) + 2H+(ac) + 2e- → H2O2(ac) ; E° = +0,68 V (se oxida)
La semi – reacción de oxidación de H2O2 se debe invertir porque está forma de reducción.
Las dos semi – reacciones quedan:
Cr2O72-(ac) + 14H+(ac) + 6e- → 2Cr3+(ac) + 7H2O(l) (semi - reacción de reducción)
H2O2(ac) → O2(g) + 2H+(ac) + 2e- (semi - reacción de oxidación)
-
Igualar las cargas de las dos semireacciones y sumarlas. La semi - reacción de reducción necesita 6 electrones y la de oxidación suministra 2 electrones. El mínimo común múltiplo es 6. La semi – reacción de reducción se multiplica por 1 y la de oxidación por 3, se suman y se simplifican las especies que aparezcan en reactivos y productos. El resultado es:
1(Cr2O72-(ac) + 14H+(ac) + 6e- → 2Cr3+(ac) + 7H2O(l))
3(H2O2(ac) → O2(g) + 2H+(ac) + 2e-) +
Cr2O72-(ac) + 14H+(ac) + 6e- + 3H2O2(ac) → 2Cr3+(ac) + 7H2O(l) + 3O2(g) + 6H+(ac) + 6e-
Se obtiene:
Cr2O72-(ac) + 8H+(ac) + 3H2O2(ac) → 2Cr3+(ac) + 7H2O(l) + 3O2(g) (ecuación Iónica neta)
La ecuación iónica neta es la contiene solo las especies involucradas en la reducción y la oxidación.
-
Se adicionan las especies espectadoras o que no intervienen en la reducción u oxidación, a reactivos y productos. En este caso son potasio, K+, e ion sulfato del ácido, SO42-.
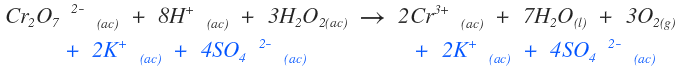
Y se obtiene:
K2Cr2O7(ac) + 4H2SO4(ac) + 3H2O2(ac) → Cr2(SO4)3(ac) + 7H2O(l) + 3O2(g) + K2SO4(ac)
(Ecuación iónica total)La ecuación iónica total es la ecuación completa para la reacción redox. De aquí en adelante se necesitará trabajar la estequiometría para la solución de problemas químicos.
