Concentración de las soluciones
La concentración es la relación de la cantidad de soluto disuelto por unidad de solución o solvente. Desde la concentración de una solución podemos hallarle la concentración a otra. A este proceso se le denomina titulación o valoración. Se requieren ciertos requisitos para la titulación de soluciones de concentración desconocida, pero una vez se cumplen es muy fácil trabajar y hallar las concentraciones buscadas.
Unidades de concentración de soluciones
La concentración de una solución es muy importante, porque al no tenerse una sustancia pura necesitamos alguna manera de calcular las moles del soluto. Son las unidades de concentración las que nos permiten calcular la cantidad de soluto en una solución.
La concentración es una relación de la cantidad de soluto disuelta por unidad de solución o solvente. La cantidad de soluto se puede dar en masa (g, kg, lb, onz), en cantidad de sustancia (moles), o partículas (átomos o moléculas).
Uno selecciona las unidades de concentración más convenientes para resolver los problemas químicos.
Las unidades de concentración de uso frecuente son:
- M (Molaridad) = Moles de soluto/L de solución.
- %p/p (porcentaje peso a peso) = (g de soluto/g de solución)*100.
- %p/v (porcentaje peso a volumen) = (g de soluto/mL de solución)*100.
- %v/v (porcentaje volumen a volumen) = (mL de soluto/mL de solución)*100.
- m (Molalidad) = Moles de soluto/kg de solvente.
- N (Normalidad) = #eq-Q de soluto/L de solución o N = M*α (α = # H+, #OH- o #e-).
- χ (Fracción molar) = n de soluto/n de solución.
- ppm (partes por millón) = mg soluto/kg solución = g soluto/g solución*106.
Por ejemplo, una solución de NaCl que se preparó colocando 135 g de la sustancia en 822 mL de solución, ¿qué molaridad tiene?.
Se calculan las moles de NaCl = 135 g /(58,45 g /mol) = 2,31 mol.
Se halla la concentración molar o molaridad.
MNaCl = 2,31 mol / 0,822 L = 2,81 Molar o 2,81 M.
Significa que por cada litro de solución preparada se tendrán 2,81 moles de NaCl. Esto en el caso de que viéramos un litro de solución.
Se pueden calcular las demás concentraciones para la solución preparada. En algunos casos se necesitará la densidad de la solución para hallar la concentración.
Preparación de soluciones
Veamos con un ejemplo la preparación de soluciones en agua. Preparar una solución de NaCl 1,25 M y 250 mL de solución.
Los pasos a seguir para preparar la solución son:
-
Cálculo de la masa de soluto a disolver.
Moles de NaCl = M*L = 1,25 M * 0,250 L = 0,3125 mo.l
Gramos de NaCl = moles*P.M. = 0,3125 mol * 58,45 g/mo = 18,27 g. - Adición de los 18,27 g de soluto soluble a 100 mL de agua (volumen menor que el volumen final de la solución).
- Solubilización completa de los 18,27 g soluto en los 100 mL de agua.
- Llevar al volumen final de 250 mL.
- Cálculo de la concentración final, de ser necesario.
Estos pasos fundamentales se pueden observar en la figura 1.
Figura 1. Pasos en la preparación de una solución.

(Para ampliar la imagen haga clic sobre ella)
Dilución de soluciones
La dilución es el proceso de preparación de una solución de menor concentración a partir de otra más concentrada. La pregunta que surge es ¿cuánto se debe tomar de la solución concentrada para preparar la diluida? En la figura 3 se presenta este interrogante.
Figura 2. Dilución de una solución

(Para ampliar la imagen haga clic sobre ella)
Durante el proceso de dilución se conservan las moles de la sustancia y que se tomaron de la solución concentrada. Únicamente cambia el volumen de solvente adicionado y de la solución final o diluida y por ende la concentración. Esto lo escribimos como:
Moles iniciales = moles finales
ninicial = nfinal
Las moles iniciales y finales se calculan a partir de la concentración de la siguiente manera: n = M*L (moles = molaridad*litros de solución)
Reemplazamos en la fórmula de igualación de moles iniciales y finales y se obtiene:
Mc*Vc = Md*Vd (fórmula de dilución)
Donde Mc es la molaridad de la solución concentrada, Vc el volumen de la solución concentrada, Md es la molaridad de la solución diluida y Vd el volumen de la solución diluida.
Se debe tener en cuenta que las unidades de concentración de la solución concentrada y diluida deben ser las mismas y los volúmenes también debe tener las mismas unidades.
La fórmula general de dilución es la siguiente:
Cc*Vc = Cd*Vd (fórmula de dilución)
Donde Cc y Cd son las concentraciones de las soluciones concentrada y diluida, respectivamente.
Esta fórmula funciona para unidades de concentración de molaridad y normalidad. También se puede usar para la unidad de concentración de partes por millón, pero solo si la solución tiene densidad 1g/mL.
Para la preparación de una dilución se requieren los siguientes pasos:
- Cálculo del volumen requerido de solución con mayor concentración a partir de la fórmula de dilución Cc*Vc = Cd*Vd.
- Toma del volumen calculado de solución concentrada y depositada en el balón aforado.
- Llevado a volumen final en el balón aforado.
- Cálculo de la concentración final de ser necesario.
Titulación de soluciones
La titulación o valoración de una solución es el proceso mediante el cual se halla la concentración de una solución desconocida, por medio de otra de concentración conocida. A la solución de concentración conocida se le denomina solución valorante y la de concentración desconocida solución valorada.
Durante la titulación se aprovechan las características de reacción de las sustancias para determinar cuándo reaccionaron completamente las dos sustancias.
Por ejemplo, a un ácido de concentración desconocida se le puede calcular la concentración titulándolo con una base. Solo necesitamos conocer cuando reaccionó completamente el ácido con la base.
Requisitos para la titulación
- Se debe conocer la ecuación de la reacción de las sustancias que reaccionan.
- La reacción debe ocurrir completamente.
- La reacción debe ser estable y ocurrir rápidamente.
- Se debe poder calcular la concentración de la solución valorante.
- Se debe poder detectar cuando se consumió toda la solución valorada. Este es el punto de equivalencia de la reacción.
Si se cumplen estos requisitos se puede llevar a cabo la valoración. En la figura se presenta un esquema del montaje de una titulación.
Figura 3. Montaje para una titulación
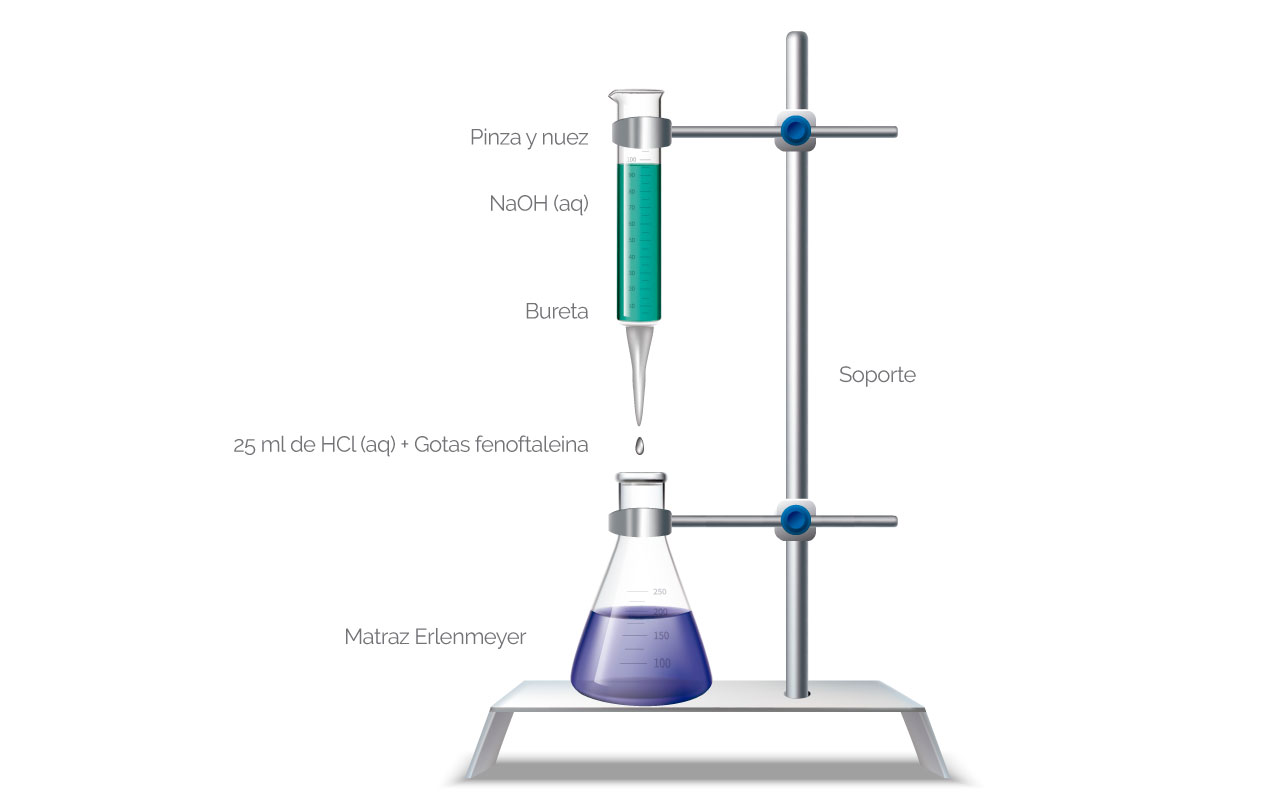
(Para ampliar la imagen haga clic sobre ella)
En este montaje se tiene dispuesto titular un ácido, HCl, que se encuentra en el Erlenmeyer, con una base, NaOH, que se encuentra en la bureta. Para saber que finalizó la reacción o titulación, al ácido se le adicionaron de 3 a 5 gotas de fenolftaleína (indicador), que cambia de incolora a rosa o fucsia cuando se llega al punto de equivalencia. Cuando se adiciona la base con la bureta se dosifica la cantidad adicionada, con la válvula y se finaliza con el cambio del indicador. Luego se lee el volumen gastado de NaOH en la bureta y se calcula la concentración del HCl con la siguiente fórmula:
CA*VA = CB*VB (fórmula de dilución)
Esta fórmula funciona para unidades de concentración de molaridad y normalidad.
Donde CA y CB son las concentraciones del ácido y la base, respectivamente. VA el volumen del ácido y VB el volumen de la base. La estequiometría de la reacción es importante. En el caso de HCl y NaOH es uno a uno (1mol HCl reacciona con 1 mol NaOH). En otros casos debe revisarse la fórmula de dilución.
Para ácido sulfúrico, H2SO4, titulado con NaOH es:
2*CA*VA = CB*VB
Cuando se trabaja con normalidad no debe modificarse la fórmula de dilución. Las modificaciones solo se realizan para unidades de concentración en molaridad.
