Nomenclatura de los compuestos
Nombre de los óxidos y las bases
Los óxidos son compuestos formados por oxígeno 2- (O2-) y otro elemento distinto de fluor, F.
Los óxidos básicos (MO2-) están formados por un metal y oxígeno 2-.
Para dar nombre a estos óxidos se coloca la palabra óxido de metal y entre paréntesis el número de oxidación del metal si este tiene más de uno. Si el metal tiene solo un número de oxidación se omite el número de oxidación. A continuación se presentan varios ejemplos.
| Óxido de metal (Nº ox.) | |
| Na2O: | Óxido de sodio |
| Al2O3: | Óxido de aluminio |
| Fe2O3: | Óxido de hierro (III) |
| FeO: | Óxido de hierro (II) |
Los óxidos ácidos (XO2-) están formados por un no metal y oxígeno 2-
Se utilizan prefijos para comunicar el número de átomos oxígeno y no metal en el óxido. Los prefijos son: mono, di, tri, tetra, penta, hexa, hepta, octa, nona y deca.
El prefijo mono solo se utiliza en el monóxido de carbono. En los demás casos cuando se tenga un solo átomo del elemento u oxígeno en la fórmula química del óxido, se omite el prefijo mono. A continuación se presentan ejemplos de nombre de óxidos ácidos.
| Prefijoóxido de prefijono-metal | |
| SO: | Óxido de azufre |
| SO2: | Dióxido de azufre |
| SO3: | Trióxido de azufre |
| N2O5: | Pentóxido de dinitrógeno |
Los hidróxidos (My(OH)y están formados por un metal y un grupo hidroxilo 1- (OH1-)
Para dar nombre a los hidróxidos se coloca la palabra hidróxido de metal y entre paréntesis el número de oxidación del metal si este tiene más de uno. Si el metal tiene solo un número de oxidación se omite el número de oxidación. A continuación se presentan varios ejemplos:
| Hidróxido de metal (Nº ox.) | |
| NaOH: | Hidróxido de sodio |
| Al(OH)3: | Hidróxido de aluminio |
| Fe(OH)3: | Hidróxido de hierro (III) |
| Fe(OH)2: | Hidróxido de hierro (II) |
Nombre de los ácidos
Los ácidos oxácidos son compuestos formados por Hidrógeno 1+ (H+), no metal z+ (Xz+) y oxígeno 2- (O2-). Es decir, ácidos que contienen oxígeno en su fórmula química.
Los ácidos se nombran de la siguiente manera: se antepone la palabra ácido prefijo raíz de no metal y sufijo.
Las raíces de los no metales se presentan a continuación.
| Hidr | IIIA | IVA | VA | VIA | VIIA | Helio |
| Bor | Carb Carbon |
Nitr | Óxido | Flúor | Neón | |
| Silic | Fosf Fosfor |
Sulf Sulfur |
Clor | Argón | ||
| Germani German |
Arseni Arsen |
Seleni Selen |
Brom | Kriptón | ||
| Telur | Yod | Xenón | ||||
| Astat | Radón |
Las raíces superiores se utilizan para los compuestos binarios que forman estos elementos y ácidos hidrácidos (que solo contienen hidrógeno y no metal). Las raíces inferiores se utilizan para los ácidos oxácidos y sales.
Al ácido principal del elemento no metálico se le da el siguiente nombre:
Ácido de raizico (terminación ico)
El ácido principal es el que tiene el número de número de oxidación principal y corresponde al número del grupo al que pertenece en notación A y B. Por ejemplo, el número de oxidación principal del nitrógeno es 5+ porque pertenece al grupo 5A. a continuación se presentan los números de oxidación principales para los elementos no metálicos y metaloides.
| IIIA (3+) | IVA (4+) | VA (5+) | VIA (6+) | VIIA (5+) | Helio | |
| Bor | Carb Carbon |
Nitr | Óxido | Flúor | Neón | |
| Silic | Fosf Fosfor |
Sulf Sulfur |
Clor | Argón | ||
| Germani German |
Arseni Arsen |
Seleni Selen |
Brom | Kriptón | ||
| Telur | Yod | Xenón | ||||
| Astat | Radón |
En rojo esta el número de oxidación principal para los elementos de cada grupo. Tener en cuenta que el grupo VII A no tiene número de oxidación principal 7+ sino 5+.
El ácido principal y el nombre para algunos elementos se presenta a continuación:
| Elemento | fórmula química | nombre |
| Boro | H3B3+O3 | ácido bórico |
| Carbono | H2C4+O3 | ácido carbónico |
| Nitrógeno | HN5+O3 | ácido nítrico |
A partir del ácido principal se nombran los demás ácidos que forme el elemento.
Si el ácido que forma el elemento tiene un oxígeno más que el ácido principal del elemento se le coloca el prefijo per a la raíz del no metal. Si el ácido formado tiene un oxígeno menos que el principal se coloca un sufijo o terminación oso al nombre del ácido en lugar de ico. Si el ácido formado tiene dos oxígeno menos que el principal se coloca el prefijo hipo a la raíz y la terminación oso al nombre del ácido en lugar de ico.
A continuación se presenta un ejemplo de esta nomenclatura para ácidos.
| N° ox. Princ. |
ÁCIDO PERRAÍZICO +10 |
HClO4(Ácido perclórico) |
|---|---|---|
|
ÁCIDO RAÍZICO -10 |
HClO3(Ácido perclórico) | |
|
ÁCIDO RAÍZOSO -10 |
HClO2(Ácido perclórico) | |
| ÁCIDO HIPORAÍZOSO |
HClO (Ácido hipocloroso) |
Los ácidos hidrácidos son compuestos formados por Hidrógeno 1+ (H+) y no metal w- (Xw-). Es decir, ácidos que contienen solo hidrógeno en su fórmula química.
Los ácidos se nombran de la siguiente manera: se antepone la palabra ácido la raíz de no metal y sufijo hídrico.
Ejemplos de ácidos hidrácidos
| Elemento | fórmula química | nombre |
| Cloro | HCl | ácido clorhídrico |
| Azufre | H2S | ácido sulfhídrico |
| Bromo | HBr | ácido bromhídrico |
| Fluor | HF | ácido fluorhídrico |
| Yodo | HI | ácido yohídrico |
No existen más ácidos hidrácidos. H2O es agua y NH3 fosfina.
Nombre de las sales
Las sales son las sustancias o compuestos iónicos formados cuando se reemplazan los hidrógenos de los ácidos.
Las sales neutras son los compuestos formados por la sustitución de todos los hidrógenos del ácido.
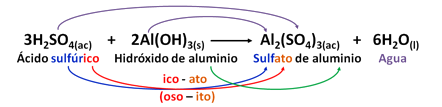
Las sales neutras se nombran de la siguiente manera: se retira la palabra ácido, se coloca la raíz del no – metal más un sufijo (modificado) de metal y entre paréntesis el número de oxidación. Si el metal solo tiene un número de oxidación este se omite.
Abreviadamente:
NOMBRE DE LA SAL: (PREFIJO)RAIZ(N-M)SUFIJO DE METAL(N° DE OX) (OXÁCIDOS)
Si la raíz del no metal trae desde el ácido un prefijo éste se conserva. Por ejemplo,
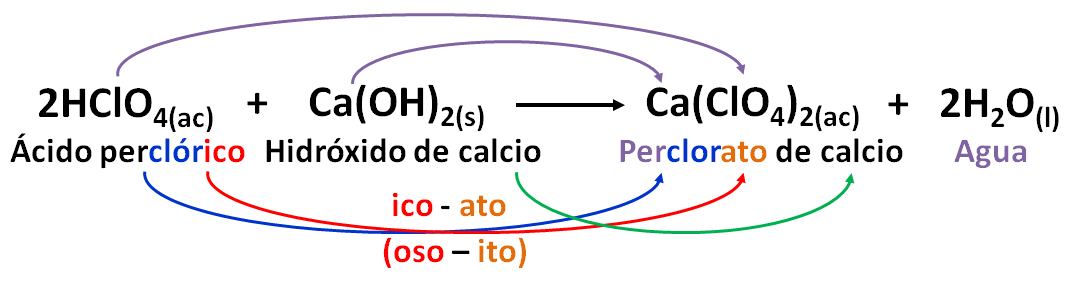
En esta sal se conserva el prefijo per que acompaña la raíz en el nombre de la sal.
A continuación se presenta otro ejemplo.
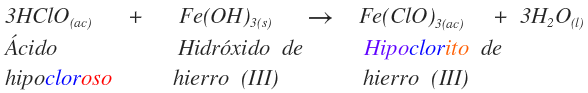
Para las sales de los ácidos hidrácidos el nombre es:
NOMBRE DE LA SAL: RAIZ(N-M)SUFIJO DE METAL(N° DE OX) (HIDRÁCIDOS)
Se ilustrará con un ejemplo:
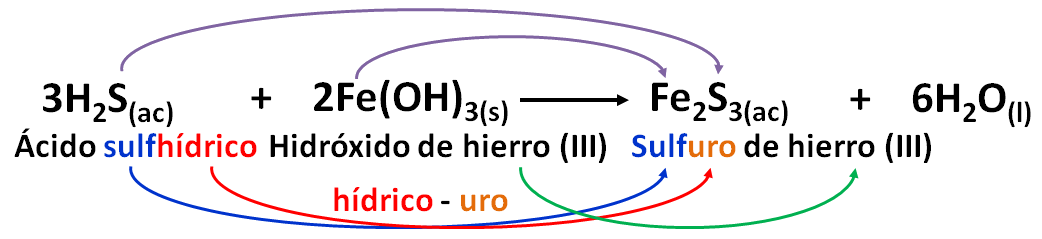
El sufijo hídrico se cambia por uro.
Las sales ácidas son los compuestos formados por la sustitución parcial de los hidrógenos del ácido.
Se introduce el término ácido para indicar que continúa conservando H+ ácidos. A continuación se dan varios ejemplos:
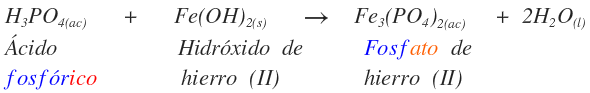
Este es el nombre de la sal neutra, fosfato de hierro (II). La ecuación no está balanceada.
Si solo se sustituye un hidrógeno se tiene:
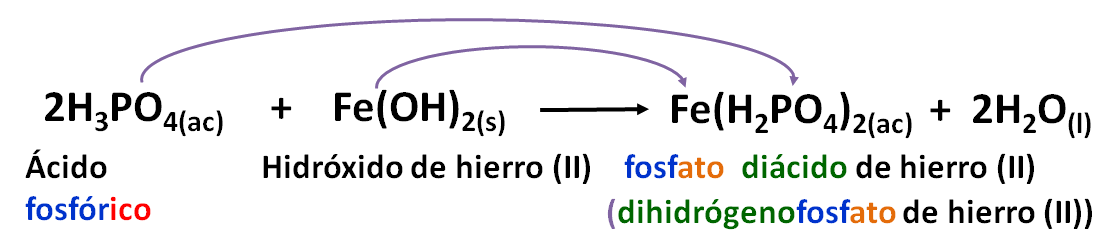
En el nombre de la sal se coloca la palabra fosfato que viene del ácido, se indica el número de hidrógenos no sustituidos y de metal (No ox) Fosfato diácido de hierro (II)
Otra forma es colocando el número de hidrógenos que no se sustituyeron como prefijo de la raízsufijo de metal (No ox).
Dihidrógeno fosfato de hierro (II)
El otro fosfato ácido es:
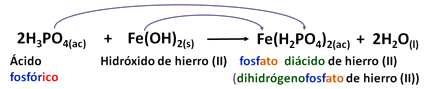
Nombrado como se mencionó antes:
Fosfato ácido de hierro (II)
Hidrógenofosfato de Hierro (II)
La ecuación no está balanceada.
También se pueden nombrar como bifosfato de hierro (II). Las sales que se les coloca como prefijo bi indican que todavía queda un hidrógeno para reemplazar en la sal.
Por eso se nombra también como:
Bifosfato de hierro (II)
Existen los bifosfatos, bicarbonatos y bisulfatos
Aquí algunos ejemplos de bicompuestos.
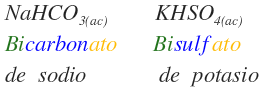
Las sales básicas son los compuestos formados por la sustitución parcial de los hidroxilos (OH-) de la base.
Se introduce el término básico para indicar que continúa conservando OH- de la base. A continuación se dan varios ejemplos.
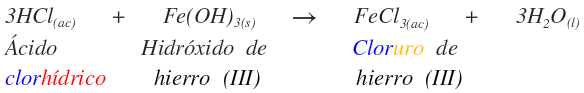
Esta es la sal neutra que se produce por la reacción completa del ácido y la base.

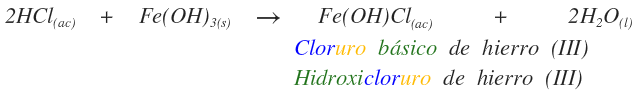
Si la reacción de la base no es completa quedan hidroxilos en la sal, se indican cuantos hidroxilos se conservan. Se coloca raízsufijo y se adiciona prefijobásico de metal (No ox).
Cloruro dibásico de hierro (III)
Otra forma es colocando un prefijo (hidroxi) a la raíz que indique el número de hidróxidos que no se sustituyeron en la base.
Dihidroxicloruro de hierro (III)
La otra sal que se puede producir es:
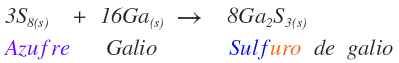
Nombre de los compuestos binarios, peróxidos, superóxidos y a partir de sus iones
Compuestos binarios iónicos
son los compuestos formados por metal y no metal.
El nombre del compuesto iónico es el siguiente:
RAÍZ (NO METAL)URO DE METAL (NO OX.)
A continuación se presentan algunos ejemplos:


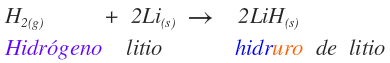
Compuestos binarios moleculares o covalentes
Son los compuestos formados por no metal y no metal.
El nombre del compuesto iónico es el siguiente:
PREFIJORAÍZ (NO METAL)URO DE PREFIJO NO-METAL
A continuación se presentan algunos ejemplos:

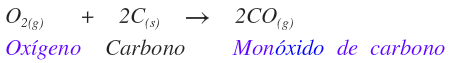

Peróxidos
Son compuestos binarios formados por oxígeno con carga 1- (O1-). Se nombran como peróxido del elemento. A continuación se presentan los peróxidos que existen.
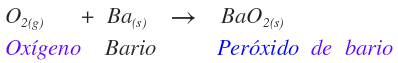


Superóxidos
Son compuestos binarios formados por oxígeno con carga ½ – (O1/2-). Se nombran como superóxido del elemento. A continuación se presentan los superóxidos que existen.


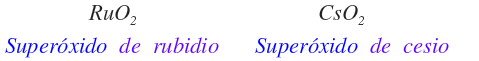
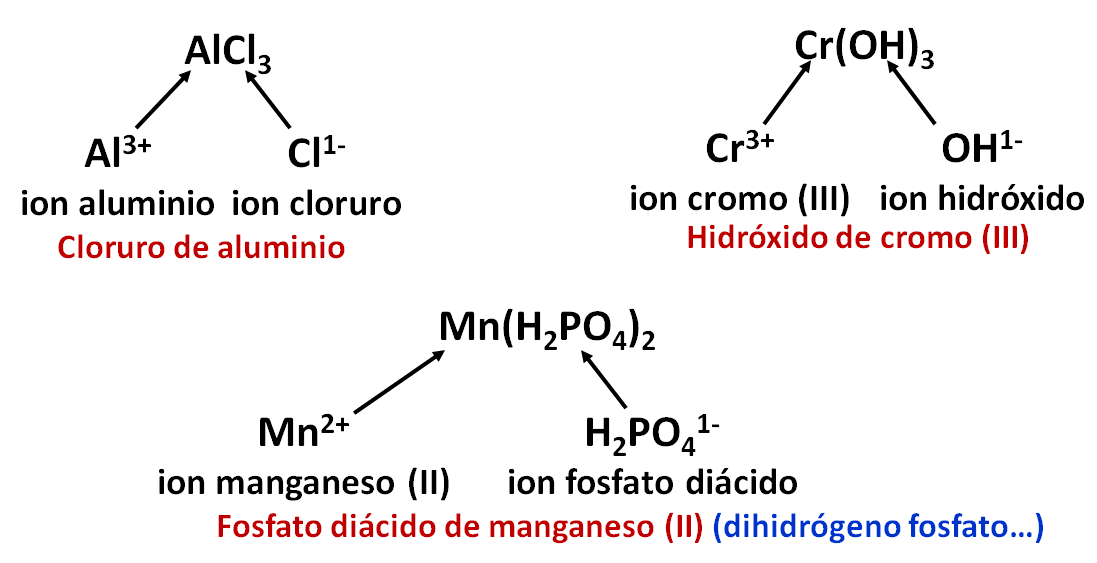
Nomenclatura de compuestos a partir de sus iones
Se pueden nombrar los compuestos a partir de sus iones, pero se requiere una buena tabla de iones. A continuación se presenta un listado de iones pero no exhaustiva.
| CATIONES COMUNES (+) | ANIONES COMUNES (-) |
| H1+ ion hidrógeno | OH1- ion hidróxido |
| NH41+ ion amonio | O2- ion óxido |
| Na1+ ion sodio | Cl1- ion cloruro |
| Ca2+ ion calcio | Br1- ion bromuro |
| Mn2+ ion manganeso (II) | CO32- ion carbonato |
| Cr3+ ion cromo (III) | CHO31- ion bicarbonato ion carbonato ácido ion hidrógenocarbonato |
| Al3+ ion aluminio |
En la fórmula del compuesto siempre se coloca primero el catión y luego el anión y se balancea la carga.
Para nombrar el compuesto se retiran las palabras iones, catión o anión, se coloca primero el nombre del anión y luego del catión. A continuación se presentan algunos ejemplos.