Enlaces químicos
Enlace iónico
Aquel átomo que perdió electrones y que quedó con carga positiva se le denomina catión y el átomo que ganó electrones, queda con carga negativa, y se denomina anión.
Basado en el principio de que las cargas opuestas se atraen podemos inferir que estos dos átomos tienen una atracción entre ellos y ésta es la que permite la formación de una molécula.
El enlace que permite la conformación de moléculas iónicas se conoce como enlace iónico. La determinación de cuál de los átomos sede electrones se basa en la electronegatividad que tenga cada uno de ellos. Cuando se tiene un delta de electronegatividad o una diferencia de electronegatividad superior a 1.7 podemos inferir que este tipo de enlaces será un enlace iónico.
Figura 1.
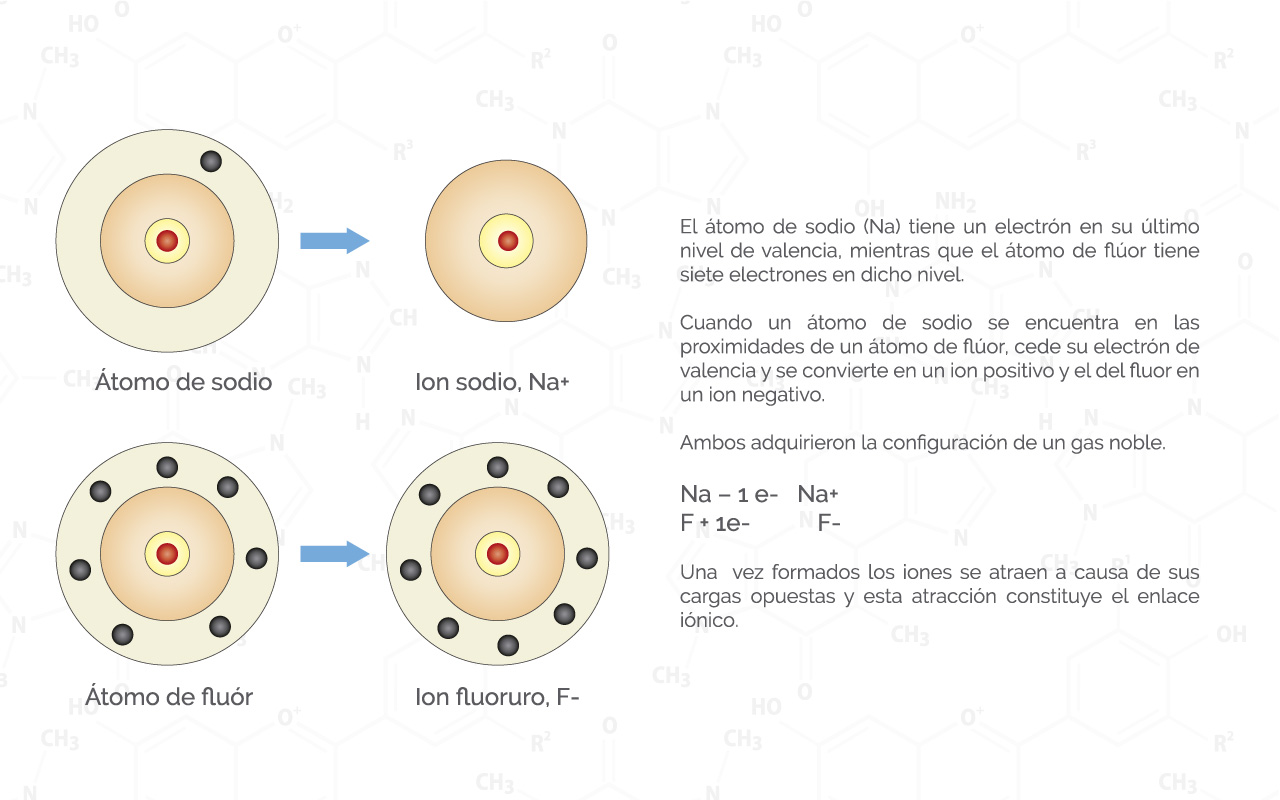
(Para ampliar la imagen haga clic sobre ella)
Enlace Covalente
Una segunda clase de enlace que vamos a considerar es aquella en la que los átomos participantes tienen electronegatividades muy importantes. En este caso ellos deben organizarse en forma tal que ninguno de ellos pierda ni ceda carga electrónica. Por ello se dice que más que un ceder y ganar es un compartir con el objetivo de completar la configuración electrónica más favorable. Es decir aquella semejante a la de los gases nobles.
En esta clase de enlaces covalentes, la diferencia de electronegatividad es menor a 0,7 unidades. Ahora bien, existe un rango de diferencias de electronegatividad que no puede ser clasificado como enlace covalente ni tampoco puede ser clasificado como enlace iónico.
Cuando se presenta una diferencia de electronegatividades en este rango indeterminado como covalente o como iónico se dice que tenemos un enlace covalente polar donde hay un compartir electrones pero no en igualdad de condiciones sino en unas condiciones bastante disparejas.
Es posible diferenciar los enlaces iónicos de enlaces covalentes en las sustancias. Las sustancias que contienen enlaces iónicos al solubilizarse se disocian en los componentes cationes y aniones mientras que las sustancias que contienen enlaces covalentes y son solubles en agua se disocian pero en moléculas separadas.
Por ejemplo: el Cloruro de sodio, que es una molécula iónica, al ingresar al agua se disuelve formando iones de cloro y iones de sodio mientras que el azúcar que también se disuelve en agua sus moléculas no se disocian sino que se dispersan unas de otras quedando en solución pero no conducen la electricidad.
El experimento que se puede llevar a cabo para ver si una molécula tiene enlaces iónicos o enlaces covalentes es solubilizar y medir la conductividad eléctrica de la solución. Si la conductividad eléctrica de la solución aumenta significa que el enlace es iónico mientras que si la conductividad no aumenta significa que la molécula está constituida por enlaces covalentes pero la molécula es soluble.
Figura 2.

(Para ampliar la imagen haga clic sobre ella)
Enlace metálico
Los metales tienen una baja electronegatividad permitiendo que los metales fácilmente entreguen electrones. Es decir poco es el esfuerzo y poca es la energía que tiene entre el núcleo y los electrones más lejanos del átomo. Es así como los átomos metálicos pueden ceder fácilmente electrones.
Debido a este tipo de enlace donde un grupo de átomos o un grupo de núcleos metálicos tienen la facilidad de recibir o entregar electrones es la que les confiere la capacidad de conducir electricidad fácilmente.
Figura 3.

(Para ampliar la imagen haga clic sobre ella)
