

El Helio es el primer elemento que completa el nivel de energía o periodo 1. Cuando un elemento llena todos los orbitales de un nivel con electrones, presenta una configuración electrónica estable, tal como para el Helio. Para el Helio, la configuración electrónica es 1s2, que en diagrama de orbitales o celdas se representa así:
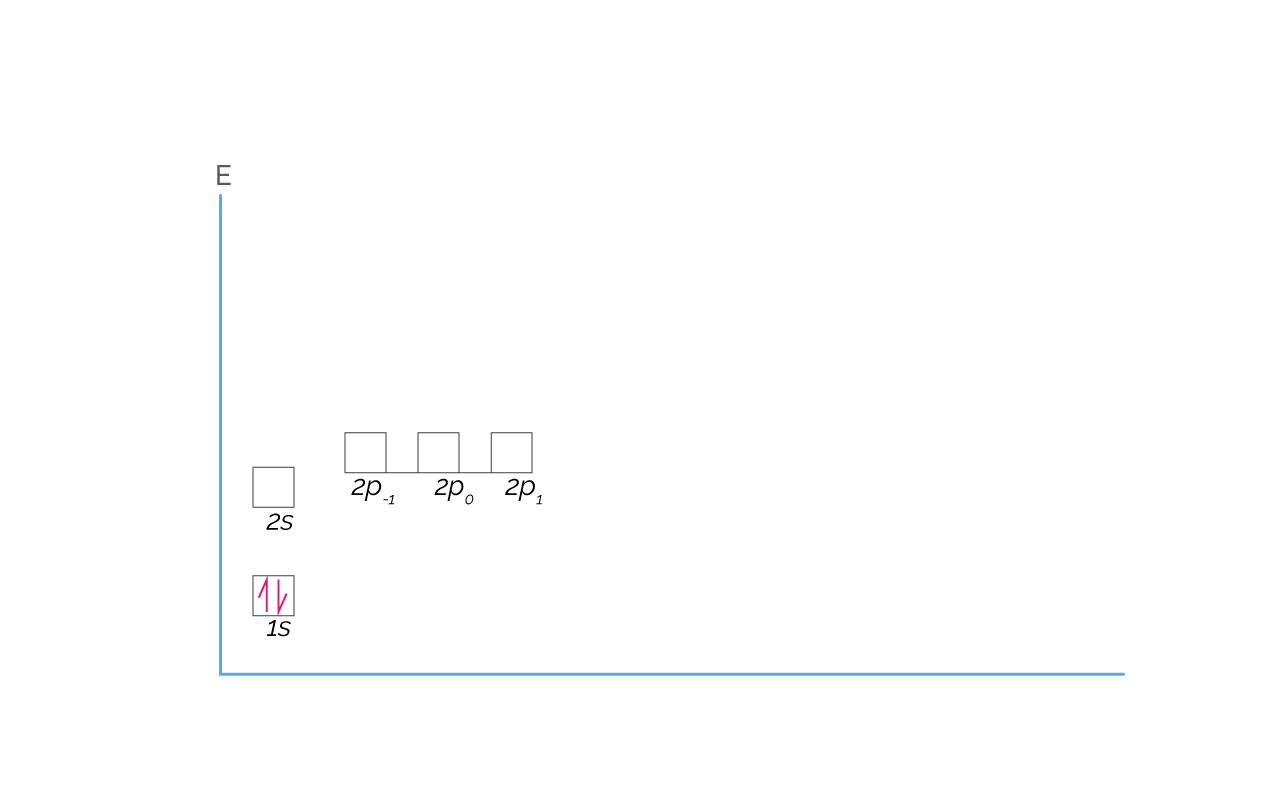
(Para ampliar la imagen haga clic sobre ella)
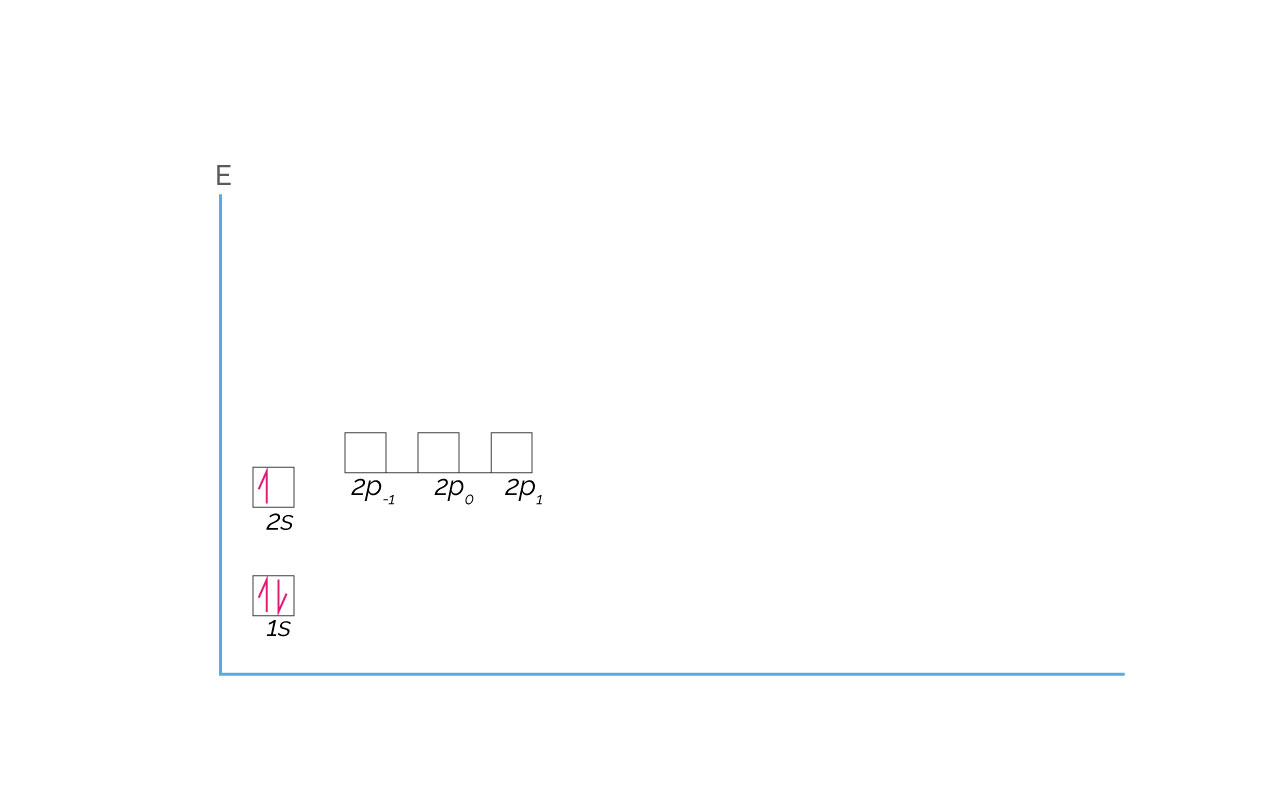
El Litio presenta configuración electrónica 1s22s1, tal cual se muestra en la figura.
El Berilio es el primer elemento que completa con electrones el orbital 2s. Su configuración electrónica es 1s22s2 y se representa de la siguiente manera:
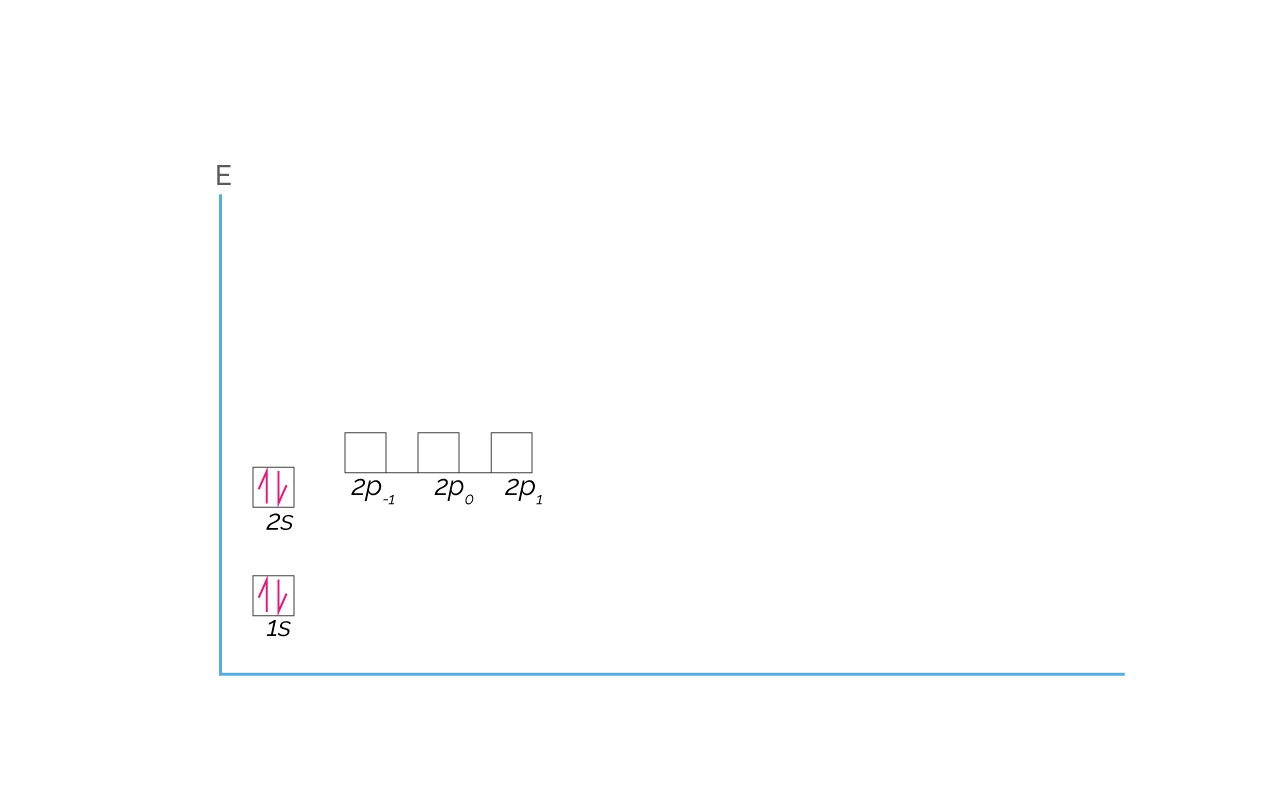
(Para ampliar la imagen haga clic sobre ella)
Si observamos atentamente la configuración electrónica de los elementos hasta aquí mencionados, todos los electrones tienen distintos números cuánticos o por lo menos difieren en uno. Por ejemplo el Berilio tiene dos electrones en el orbital 2s con números cuánticos (2, 0, 0, ½) y (2, 0, 0, -½). A pesar de que se encuentran los dos electrones en el mismo orbital atómico y coinciden sus tres primeros números cuánticos, difieren en el de spin.
Con el Boro se comienzan a llenar los orbitales atómicos 2p. La configuración electrónica del boro es 1s22s22p1 que a continuación se representa:
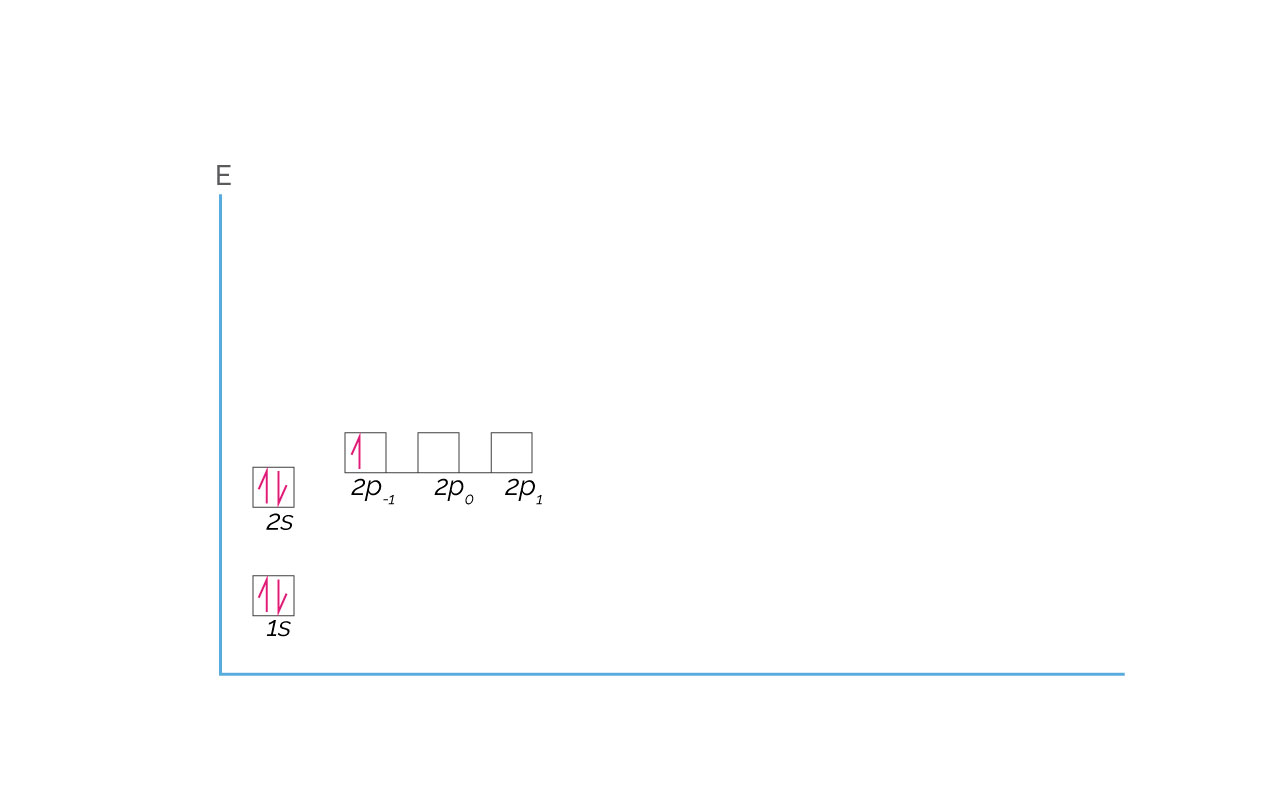
(Para ampliar la imagen haga clic sobre ella)
El Carbono tiene configuración electrónica 1s22s22p2. Se podría suponer que los dos electrones en los orbitales 2p ocuparan un mismo orbital, el 2p-1, pero los electrones se distribuyen en orbitales 2p distintos. Si los dos electrones ocuparan el mismo orbital tendrían una repulsión por carga eléctrica, que se disminuye cuando los dos están en orbitales 2p diferentes. Esta es su representación:
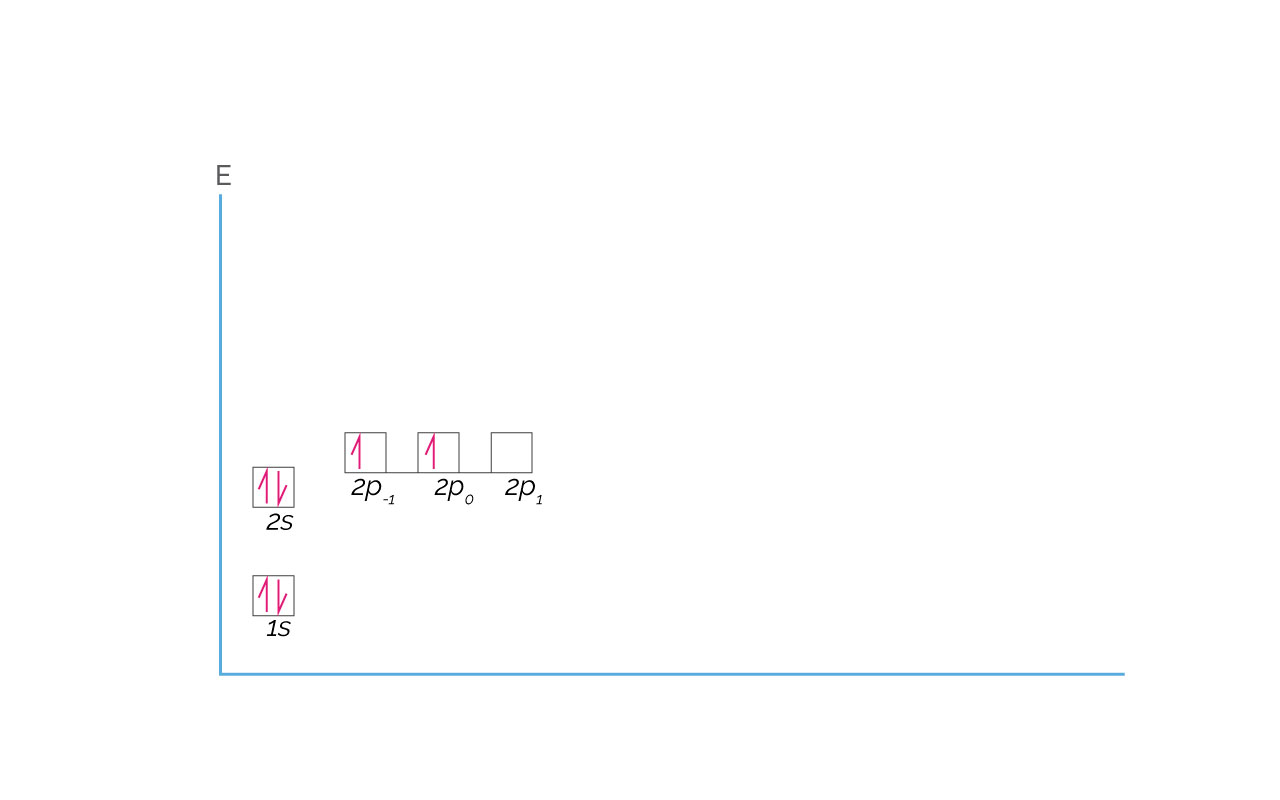
(Para ampliar la imagen haga clic sobre ella)
Esta regla de primero semillenar con electrones todos los orbitales de la misma energía, antes de llenarlos completamente, se conoce como regla de Hund. Además, se semillenan de izquierda a derecha o de menor a mayor valor de ml. De acuerdo con la regla de Hund, la configuración electrónica del Nitrógeno es 1s22s22p3 y se representa a continuación:
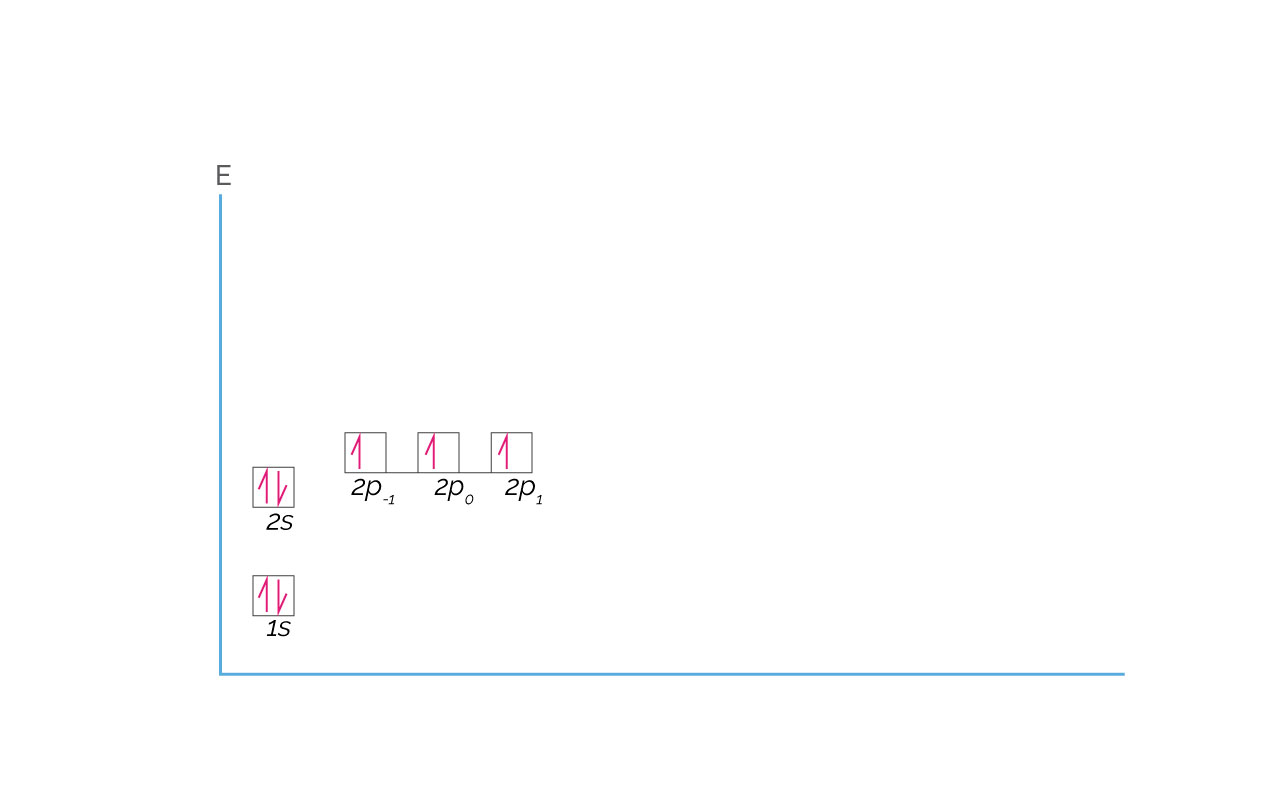
(Para ampliar la imagen haga clic sobre ella)
La configuración electrónica del Oxígeno es 1s22s22p4 y se representa así:
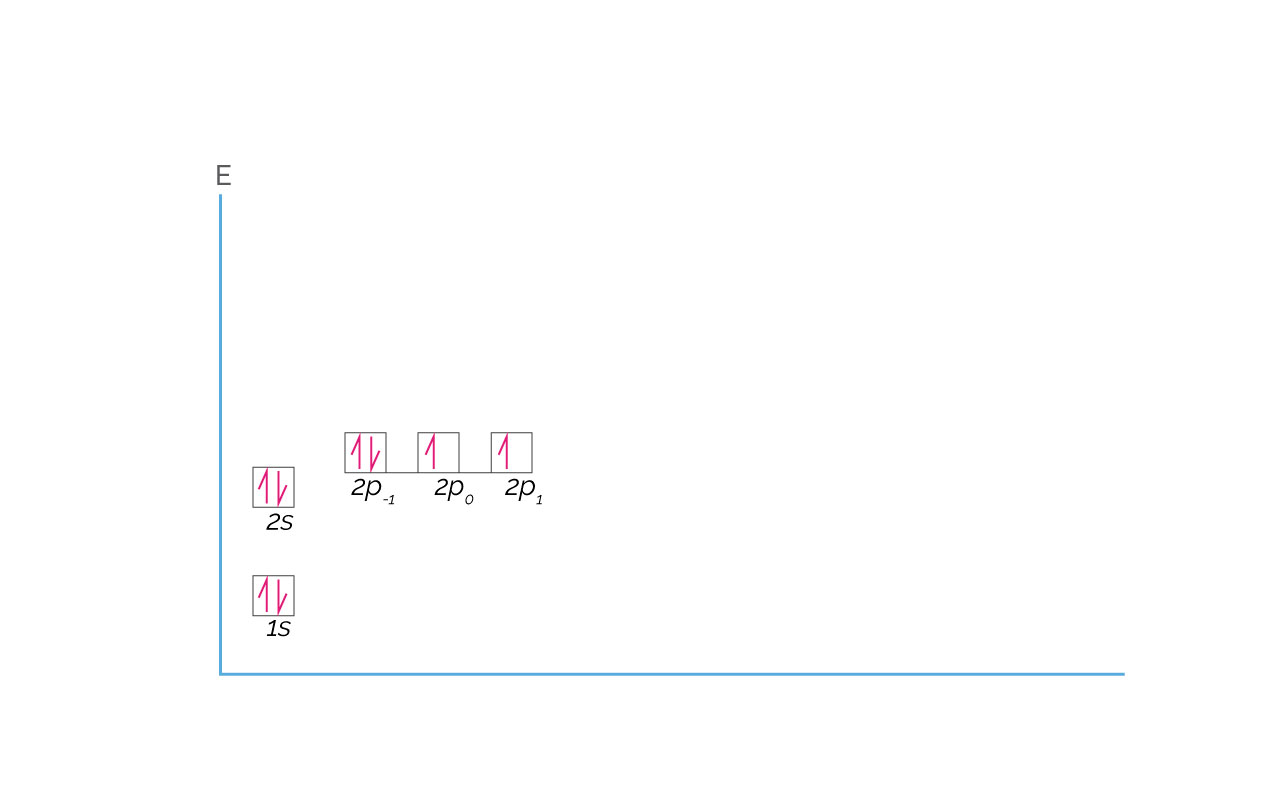
(Para ampliar la imagen haga clic sobre ella)
También se terminan de llenar los orbitales atómicos que tienen la misma energía, de izquierda a derecha o de menor a mayor valor de ml.
Después del Fluor, que tiene configuración electrónica 1s22s22p5, el Neón es el elemento que completa el periodo o nivel 2. Cuando un elemento llena todos los orbitales de un nivel con electrones, presenta una configuración electrónica estable, tal como para el Neón. La configuración electrónica del Neón es 1s22s22p6 y se representa a continuación:
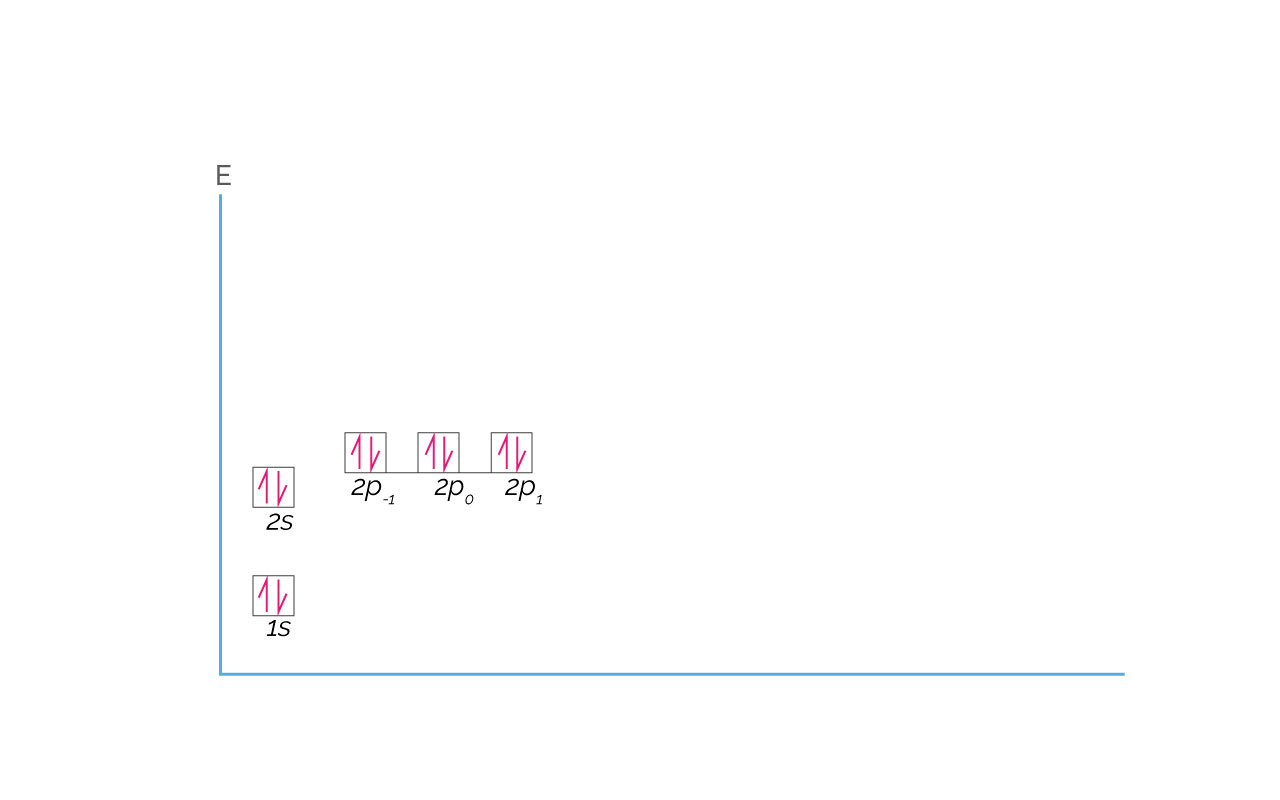
(Para ampliar la imagen haga clic sobre ella)
Por ejemplo, la configuración electrónica del hierro es [Ar]3d64s2 o [Ar]4s23d6 que significa que se completan todos los orbitales atómicos con electrones hasta el Argón (18 electrones, 1s22s22p63s23p6) y además los orbitales 3d con 6 electrones y 4s con dos. A continuación se representa la configuración del hierro:
(Para ampliar la imagen haga clic sobre ella)
Se reitera que lo importante para los electrones de un átomo, es la interpretación de la configuración electrónica más que aprender reglas nemotécnicas de asignación de orbitales.+
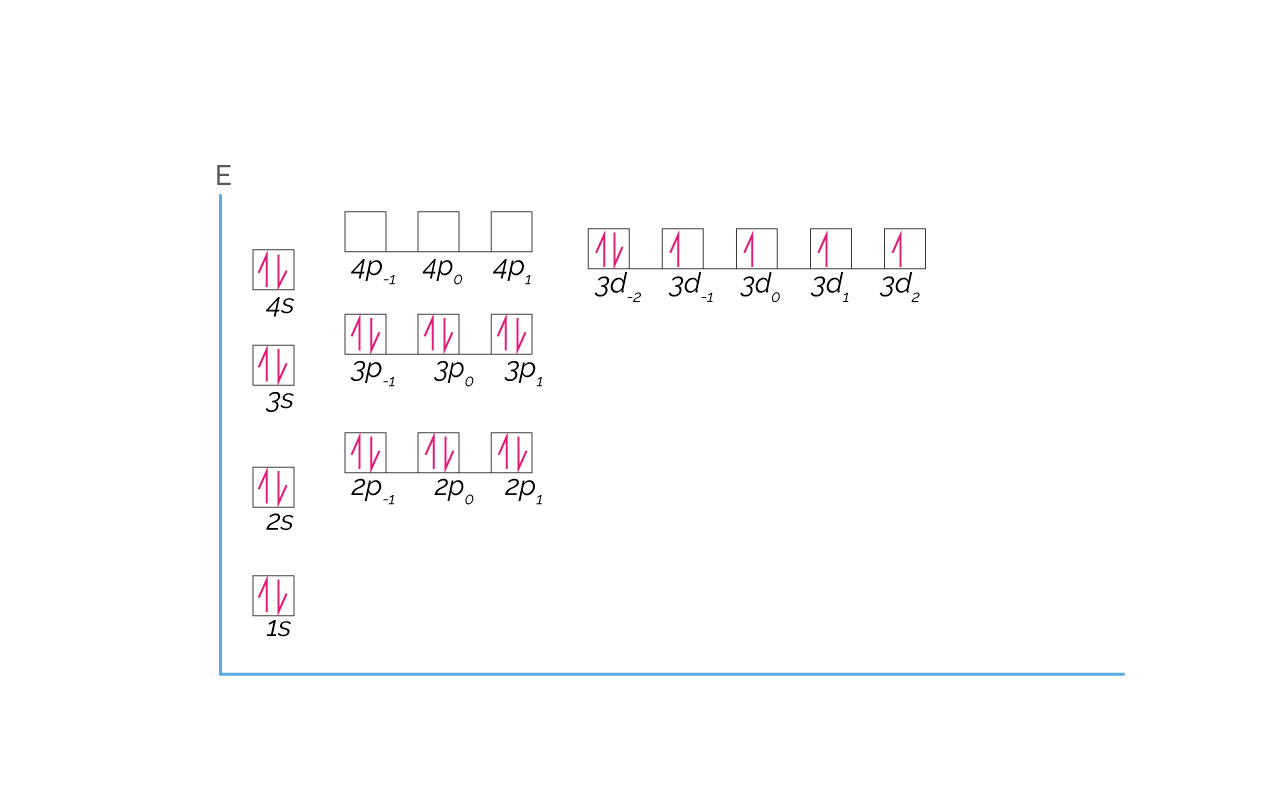
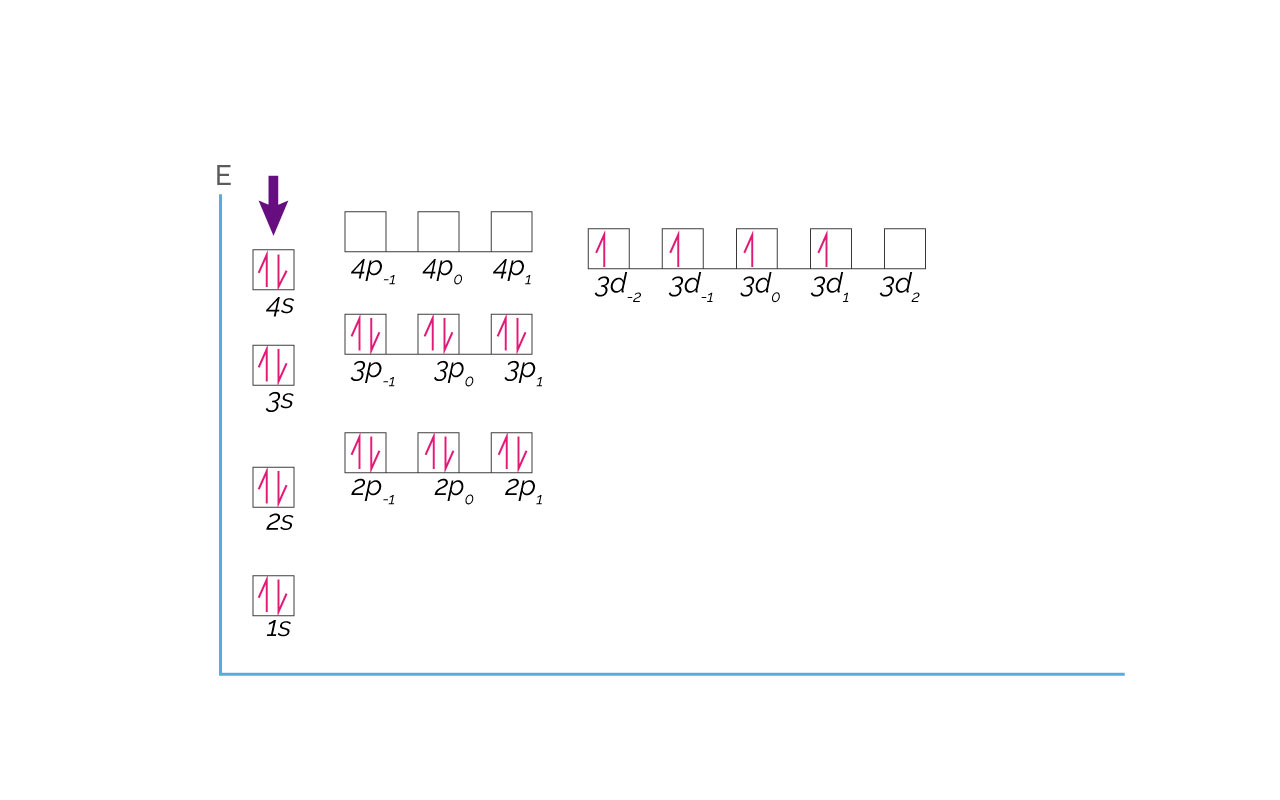
Un caso concreto de anomalía de la configuración electrónica es la del elemento Cromo con número atómico 24. Este elemento se encuentra en el cuarto periodo de la tabla y por lo tanto debe tener sus orbitales completamente llenos hasta el periodo 3 que corresponde al Argón (18 electrones). Debe llenar el orbital 4s (2 electrones) y los restantes 4 deben estar en orbitales 3d. La configuración electrónica esperada es [Ar]3d44s2. La configuración verdadera del Cromo es [Ar] 3d54s1. La diferencia está en la posición de un electrón en un orbital. A continuación se presenta la configuración esperada y la configuración verdadera para el Cromo.
Configuración esperada para el Cromo:
(Para ampliar la imagen haga clic sobre ella)
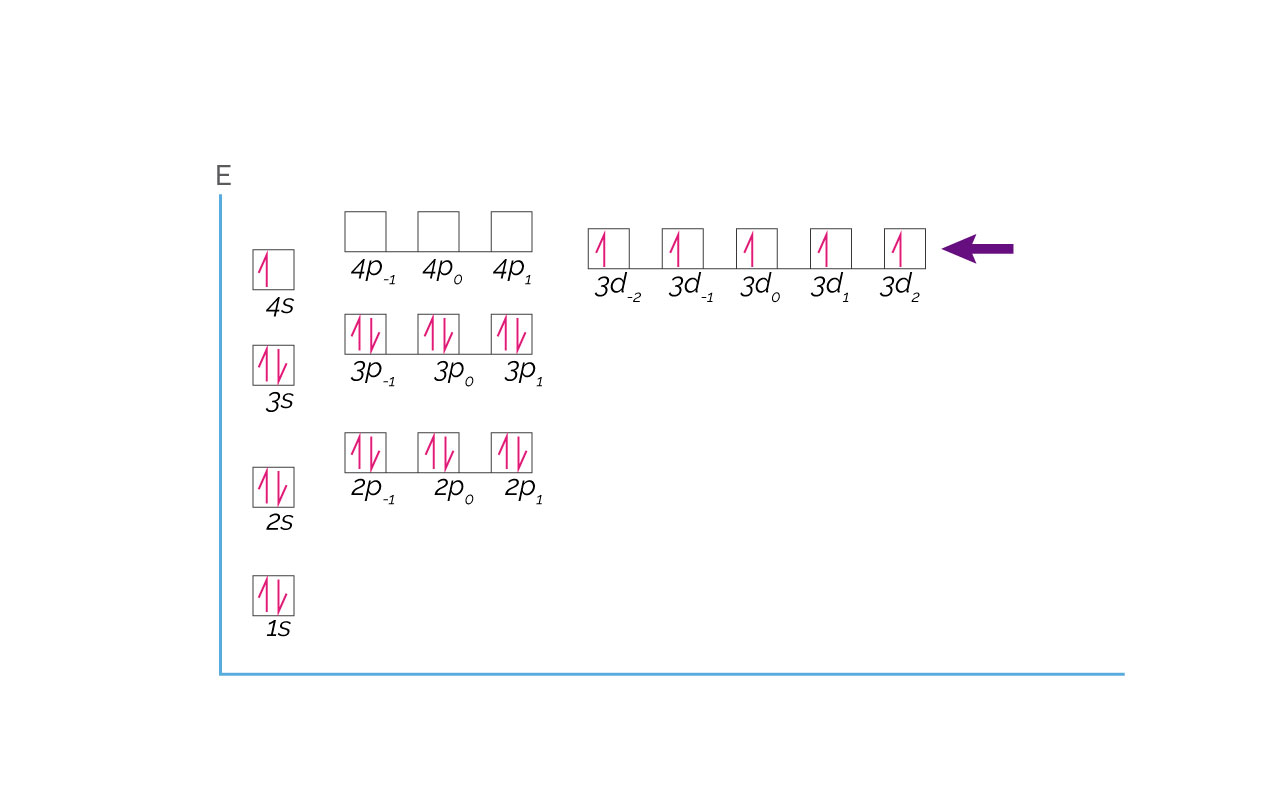
Configuración verdadera para el Cromo:
(Para ampliar la imagen haga clic sobre ella)
Dicha anomalía se explica de la siguiente manera: el electrón del cromo en el orbital 4s, con números cuánticos (4, 0, 0,-½) y señalado con una flecha roja en la representación de la configuración electrónica esperada para el Cromo, se encuentra compartiendo el orbital con otro electrón, lo que genera cierta inestabilidad.
Pero, la diferencia energética entre el orbital 4s y los 3d es pequeña. De esta manera, el electrón (4, 0, 0, -½) se posiciona en un orbital 3d2 vacío, señalado con una flecha roja en la representación de la configuración verdadera para el Cromo. Este proceso es favorable y ocurre. En consecuencia el Cromo presenta configuración electrónica [Ar] 3d54s1. Existen bastantes elementos con anomalías en su configuración electrónica y las reglas nemotécnicas de interpretación de la configuración electrónica no contemplan dichas anomalías. Lo recomendado es aprender a interpretar la información que está en la tabla periódica para entender las características y el comportamiento de los elementos químicos.
Con el Hierro y el Cromo se trabajó la configuración electrónica abreviada. Para el Hierro [Ar] 3d64s2 y para el Cromo [Ar] 3d54s1. Los cambios energéticos importantes solo ocurren en los electrones del último nivel, que para el Hierro y el Cromo son 3d64s2 y 3d54s1, respectivamente.
Estos electrones del último nivel o capa reciben el nombre de electrones de valencia o capa de valencia. La importancia radica en que los electrones de valencia son los encargados de establecer enlaces entre átomos y de explicar muchas características de los mismos. De aquí en adelante se recurrirá reiterativamente a dichos electrones.