

Este indica el nivel de energía que ocupa el electrón en el átomo. El número cuántico principal n toma valores enteros positivos desde 1. Los valores que toma n se pueden escribir de la siguiente manera:
n = 1, 2, 3, 4, 5,…… (a mayor valor del nivel, mayor energía)
En la figura 1 se puede observar el esquema de representación de los niveles energéticos de n dentro del átomo.
Figura 1. Representación de n en escala energética

(Para ampliar la imagen haga clic sobre ella)
En algunos libros se representa cada nivel con una letra mayúscula del alfabeto de la siguiente manera:
n = 1(K), 2(L), 3(M), 4(N), 5(O), 6(P).....
En la tabla periódica el número cuántico n está representado por las filas o periodos químicos. La primera contiene los elementos hidrógeno y helio. Es decir que estos elementos tienen sus electrones en el primer nivel energético.
Los elementos litio a neón, pertenecen al segundo nivel o periodo. Es decir que estos elementos tienen electrones en los niveles 1 y 2.
De esta manera se interpreta el número cuántico principal. Cada elemento que se encuentra en un determinado nivel o periodo de la tabla periódica, tiene electrones en ese nivel y en todos los niveles anteriores.
Indica el subnivel dentro del nivel energético que ocupa el electrón y depende de n.
Los valores que toma l van desde cero hasta n – 1 (valor máximo).
Se pueden escribir los valores que toma l de la siguiente manera:
l = 0, 1, 2, 3, 4, 5…. n-1. Cada valor de l tiene una letra minúscula del alfabeto asignada.
Podemos escribir la asignación de la siguiente manera:
l = 0(s), 1(p), 2(d), 3(f), 4(g), 5(h)….
Por ejemplo, si n = 1 ⇒ l = 0, es decir s; porque l toma valores desde cero hasta n – 1 que también es cero. Entonces el único valor que toma l en este caso es cero y es representado por la letra s.
Para otros valores de n se tiene que:
n = 2 ⇒ l = 0(s), 1(p)
n = 3 ⇒ l = 0(s), 1(p), 2(d)
n = 4 ⇒ l = 0(s), 1(p), 2(d), 3(f)
n = 5 ⇒ l = 0(s), 1(p), 2(d), 3(f), 4(g)
Figura 2. Representación de n y l en escala de energía
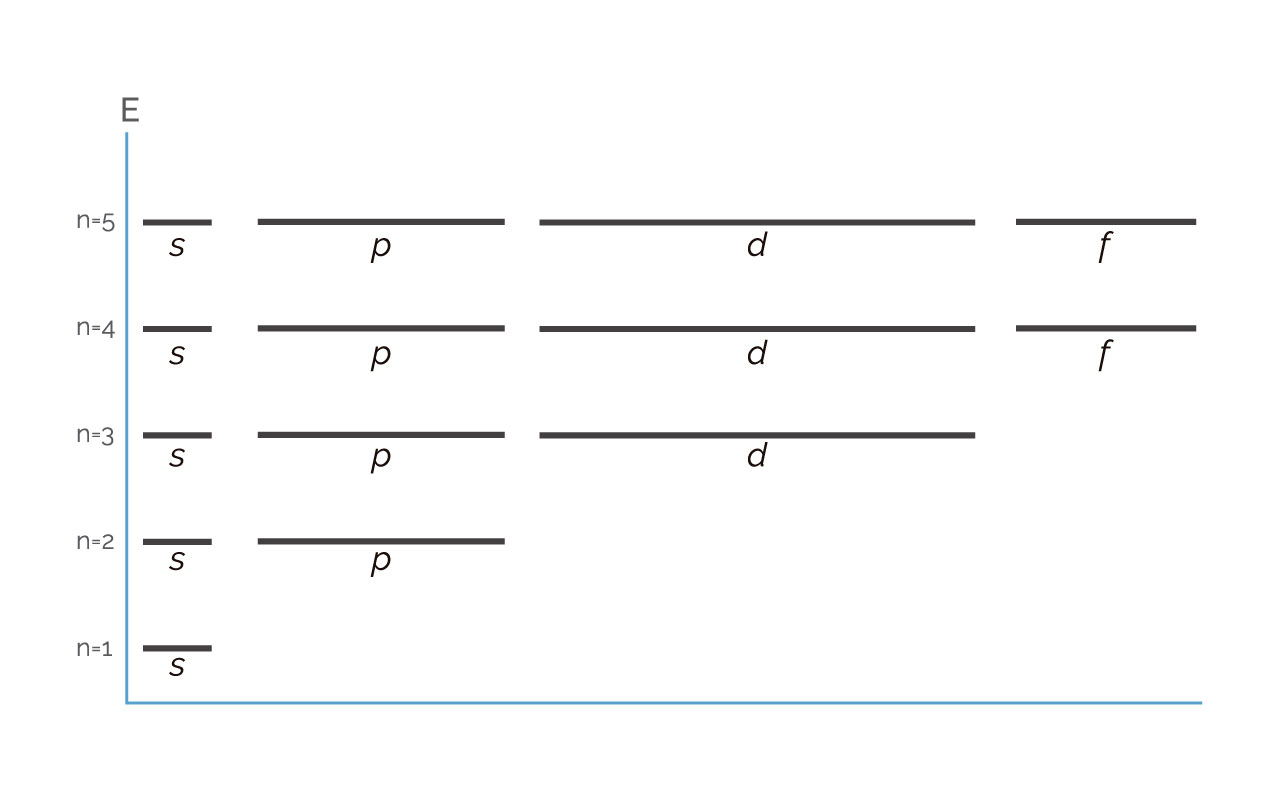
(Para ampliar la imagen haga clic sobre ella)
En la figura no se representó el subnivel g para n = 5, pero allí debe estar, más a la derecha.
Este número cuántico indica la orientación de la región energética del electrón determinada por n y l.
ml toma valores enteros desde – l pasando por cero hasta l. Los valores que toma ml se pueden escribir de la siguiente manera:
ml = 0, ±1, ±2, ±3, ±4, ±5…..± l
También se pueden escribir como,
ml : - l…-5, -4, -3, -2, -1, 0, 1, 2, 3, 4, 5…l
Revisemos los valores de n, l y ml a continuación.
| n = 1 | ⇒ l = 0(s) ⇒ ml = 0; en este caso l vale cero, entonces ml toma valores desde cero hasta cero. |
| n = 2 | ⇒ l = 0(s) ⇒ ml = 0; en este caso l vale cero, ml toma valores de cero hasta cero. |
| ⇒ l = 1(p) ⇒ ml = -1, 0, 1; en este caso l vale uno, ml toma valores de -1 a 1. |
| n = 3 | ⇒ l = 0(s) ⇒ ml = 0; en este caso l vale cero, ml toma valores de cero hasta cero. |
| ⇒ l = 1(p) ⇒ ml = -1, 0, 1; en este caso l vale uno, ml toma valores de -1 a 1. | |
| ⇒ l = 2(d) ⇒ ml = -2, -1, 0, 1, 2; en este caso l vale 2, ml toma valores de 2 a 2. |
| n = 4 | ⇒ l = 0(s) ⇒ ml = 0 |
| ⇒ l = 1(p) ⇒ ml = -1, 0, 1 | |
| ⇒ l = 2(d) ⇒ ml = -2, -1, 0, 1, 2 | |
| ⇒ l = 3(f) ⇒ ml = -3, -2, -1, 0, 1, 2, 3 |
| n = 5 | ⇒ l = 0(s) ⇒ ml = 0 |
| ⇒ l = 1(p) ⇒ ml = -1, 0, 1 | |
| ⇒ l = 2(d) ⇒ ml = -2, -1, 0, 1, 2 | |
| ⇒ l = 3(f) ⇒ ml = -3, -2, -1, 0, 1, 2, 3 | |
| ⇒ l = 4(g) ⇒ ml = -4, -3, -2, -1, 0, 1, 2, 3, 4 |
La representación de ml en una escala energética se presenta en la figura 3.
Figura 3. Representación de n, l y ml en una escala de energía
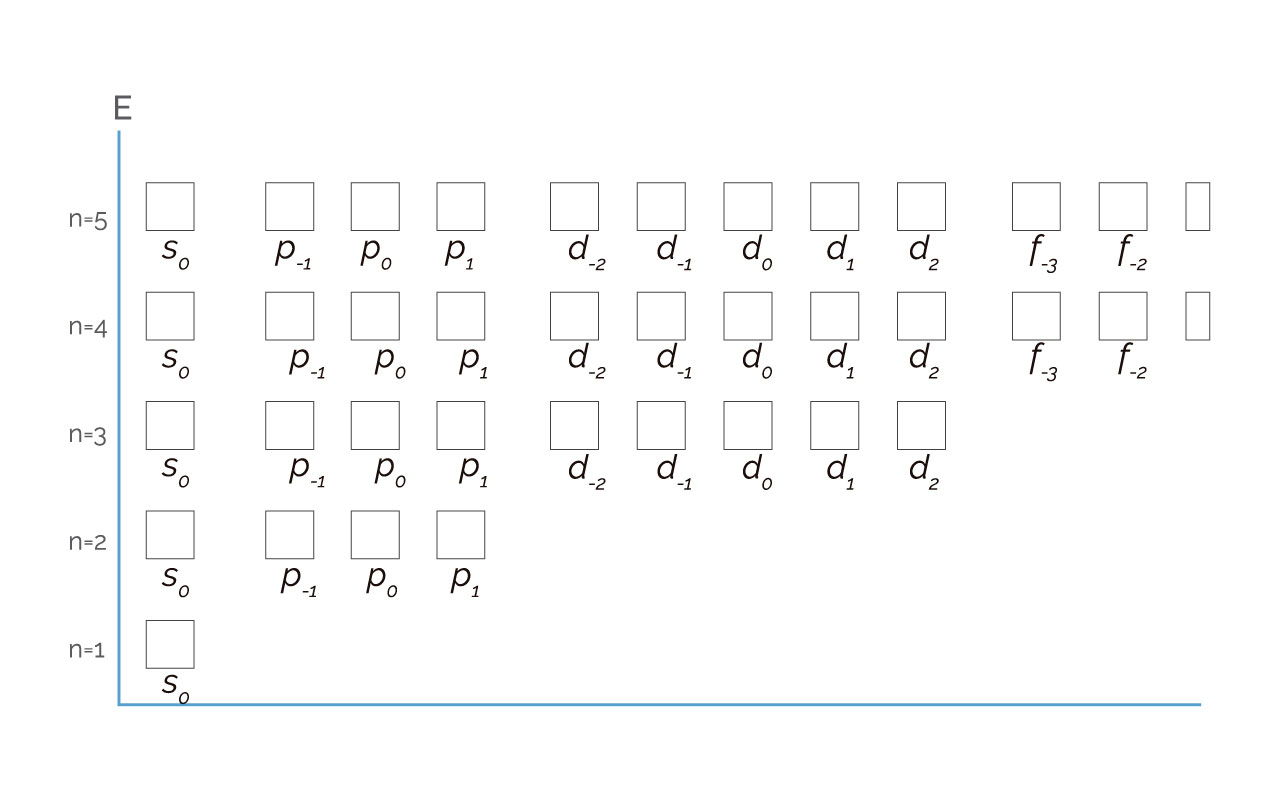
(Para ampliar la imagen haga clic sobre ella)
Cada celda, caja o rectángulo representa un valor que toma ml en el subnivel y nivel correspondiente.
Una vez que nosotros construimos las celdas a partir de los valores de n, l y ml podemos aclarar que dicha combinación se conoce como orbital atómico.
Este número cuántico indica el valor del campo magnético o impulso angular del electrón en el orbital atómico que ocupa. Debido a que el electrón es una partícula cargada cuando gira genera un campo magnético.
En los orbitales atómicos los dos electrones tienen spin pero opuesto. En la figura siguiente se ejemplifica el spin de los electrones alojados en un orbital.
Figura 4.
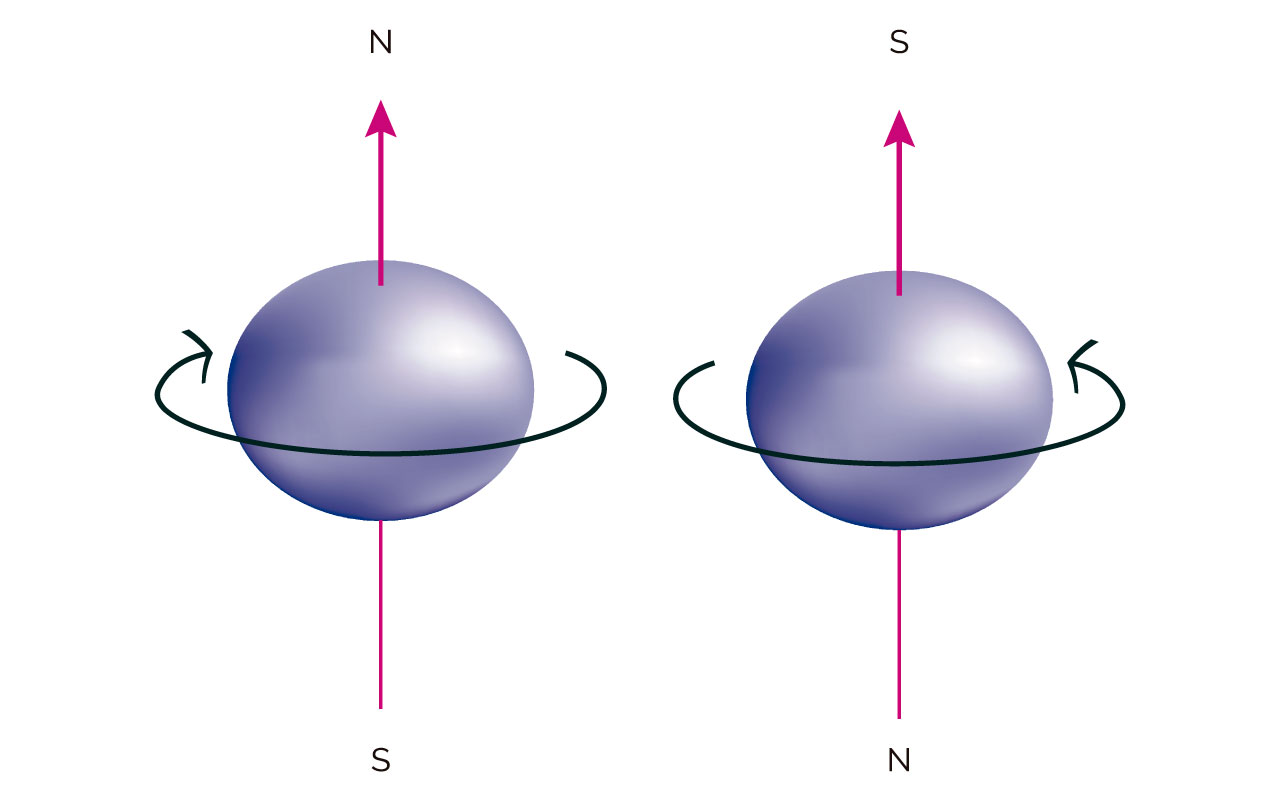
(Para ampliar la imagen haga clic sobre ella)
Spin del electrón. Tomada y adaptada de Chemistry. The Central Science (9a Ed) por Brown, New Jersey: Pearson, Prentice Hall. Derechos de autor, 2002.
El electrón con el norte hacia arriba presenta número cuántico de spin o spin ½ y el otro con el sur hacia arriba presenta spin -½.
Estos valores de spin se refieren al valor del impulso angular del giro del electrón sobre sí mismo o el valor del campo magnético generado en magnetones de Bohr.
Un orbital atómico aloja dos electrones máximo, pero con spines opuestos, -½ y ½, porque de esta manera se estabiliza la repulsión por carga eléctrica (negativa) de los dos electrones. A los dos electrones que ocupan un orbital y que tienen spines opuestos se les denomina electrones apareados. Los cuatro números cuánticos para un electrón en un átomo se pueden escribir entre paréntesis así:
(n, l, ml, ms)
Por ejemplo, un electrón en un átomo que tiene números cuánticos n igual 4, l igual a 3, ml igual a -2 y ms de ½, se representa así:
(4, 3, -2, ½)