Primeros experimentos
Los primeros experimentos que ayudaron a comprender la naturaleza eléctrica, positiva y negativa, de los constituyentes de la materia fueron desarrollados y publicados por Jöns Jacob Berzelius a principios del siglo XIX.

Los primeros experimentos que ayudaron a comprender la naturaleza eléctrica, positiva y negativa, de los constituyentes de la materia fueron desarrollados y publicados por Jöns Jacob Berzelius a principios del siglo XIX.
Más tarde en 1850, con el experimento del tubo de rayos catódicos (figura 1), William Thomson, reveló la existencia de partículas cargadas negativamente en la materia, que coincidían con un tipo de partículas, las β, que se producían durante la descomposición de muestras radioactivas (figura 2) y el calentamiento o iluminación de los metales. A este tipo de partículas se le dio el nombre de electrones.
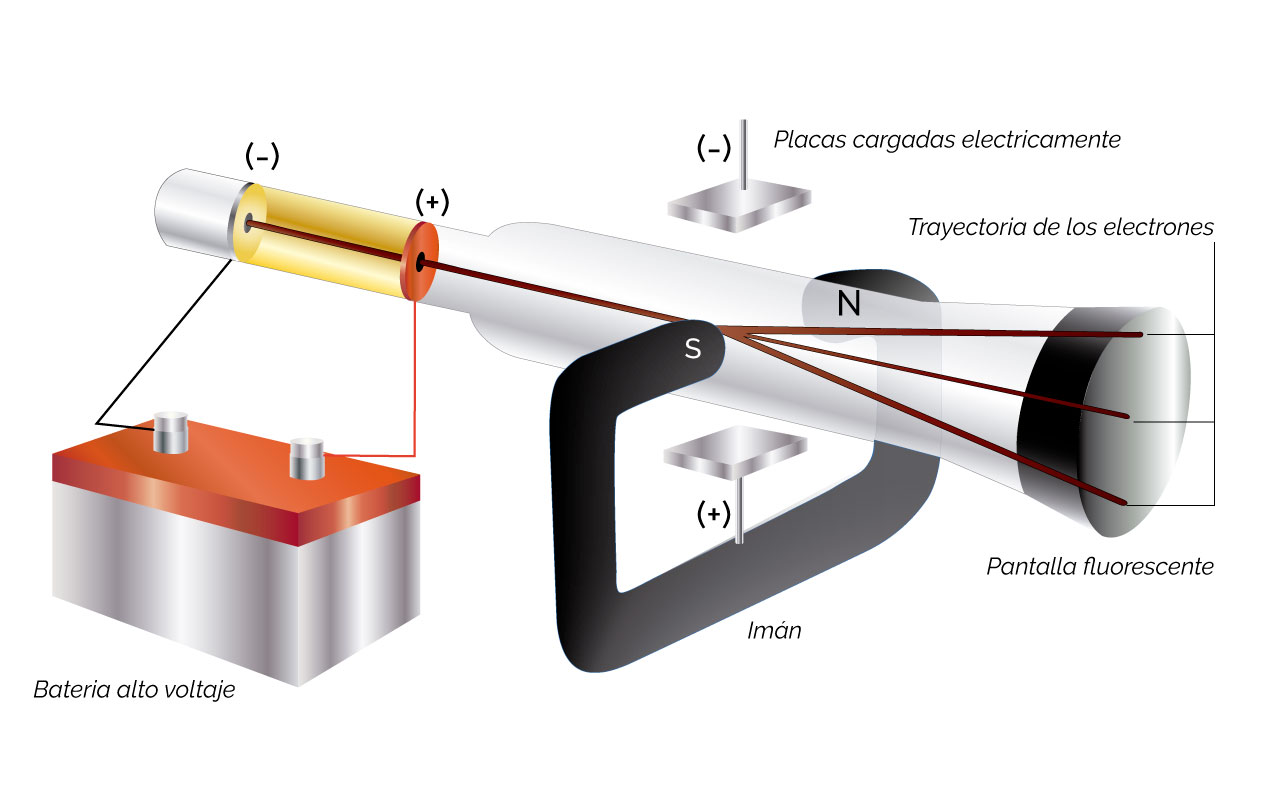
Figura 1. Experimento del tubo de rayos catódicos. Tomada y adaptada de Chemistry. The Central Science (9a Ed) por Brown, New Jersey: Pearson, Prentice Hall. Derechos de autor, 2002.
Explicación figura 1. Este fue el dispositivo para el experimento de caracterización de las partículas producidas en el tubo de descarga eléctrica o de rayos catódicos. Las partículas son desprendidas del material del electrodo negativo (–), debido al alto voltaje producido por la batería y recorren el trayecto del electrodo negativo (–) al electrodo positivo (+), que corresponde a la zona en amarillo. Algunas partículas pasan a través del orificio central del electrodo positivo (+). Estas son afectadas por campos eléctricos (placas cargadas eléctricamente) y magnéticos (imán) y se detectan sus cambios en las trayectorias en la pantalla fluorescente. Las mismas responden de acuerdo con características de partículas cargadas negativamente. A estas partículas se les denominó electrones. Estas son las partículas negativas más pequeñas, desde el punto de vista químico.
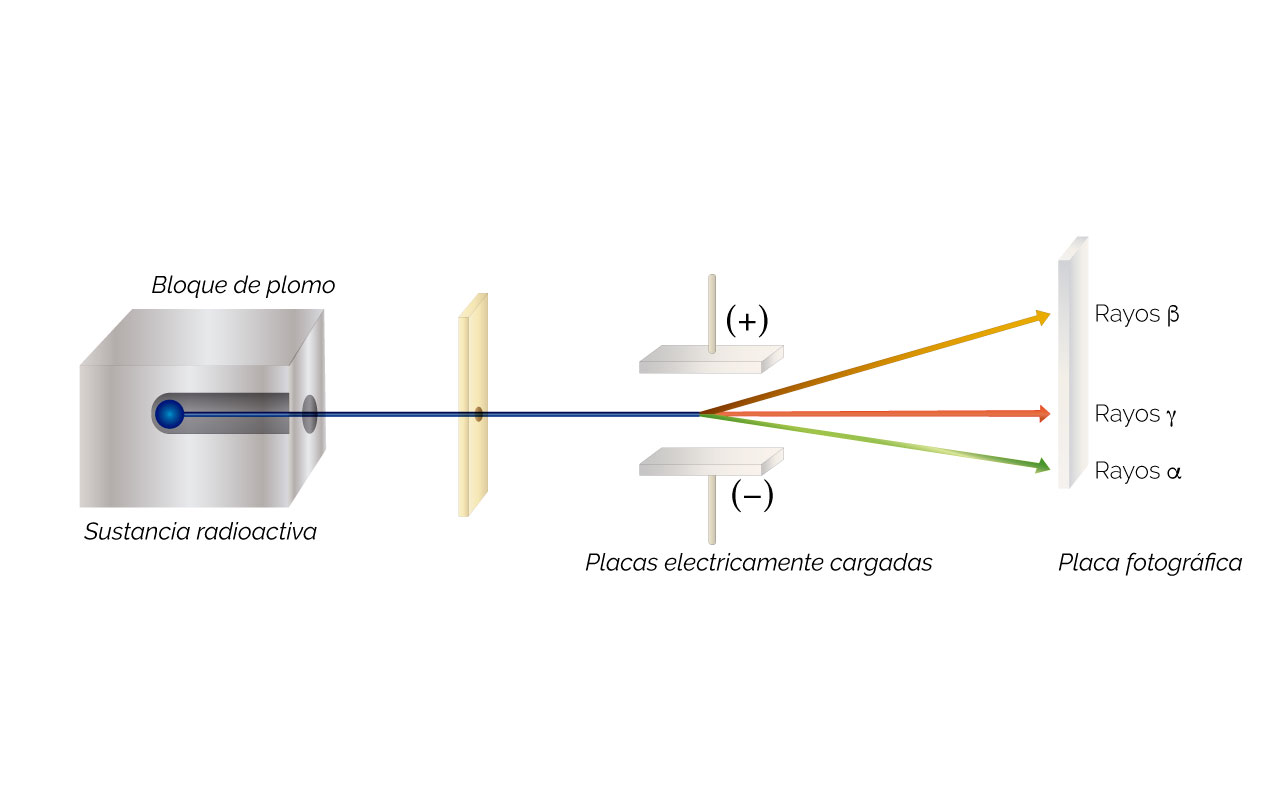
Figura 2. Descomposición de muestras radioactivas. Tomada y adaptada de Chemistry. The Central Science (9a Ed) por Brown, New Jersey: Pearson, Prentice Hall. Derechos de autor, 2002.
Explicación figura 2. Experimento de descomposición de muestras radioactivas y caracterización de las radiaciones emitidas. La placa positiva (+) atrae las partículas negativas y desvían su trayectoria hacia arriba. Estas partículas son las mismas que las producidas en el tubo de descarga. En este caso se les denominan rayos o partículas β.
La placa negativa (–) atrae las partículas positivas que desvían su trayectoria hacia abajo. Estas partículas son denominadas rayos o partículas α.
Otros rayos, los γ, no son atraídos por ninguna de las placas. Estos no tienen carga eléctrica y están compuestos por radiación electromagnética de alta energía.
La carga y masa de los electrones son:
• Carga: –1,60218x10-19 C. Carga relativa menos uno (–1).
• Masa: 5,4858x10-4 uma (unidades de masa atómica).
Como se suponía que la materia era eléctricamente neutra, entonces los demás constituyentes de los átomos deberían neutralizar la carga de los electrones. Para esto se desarrollaron varios modelos del átomo, como el de Stark y el pudin de pasas (figura 3) de Thomson en 1890. Este último suponía que los electrones se encontraban inmersos en un átomo con carga positiva distribuida dentro del mismo.
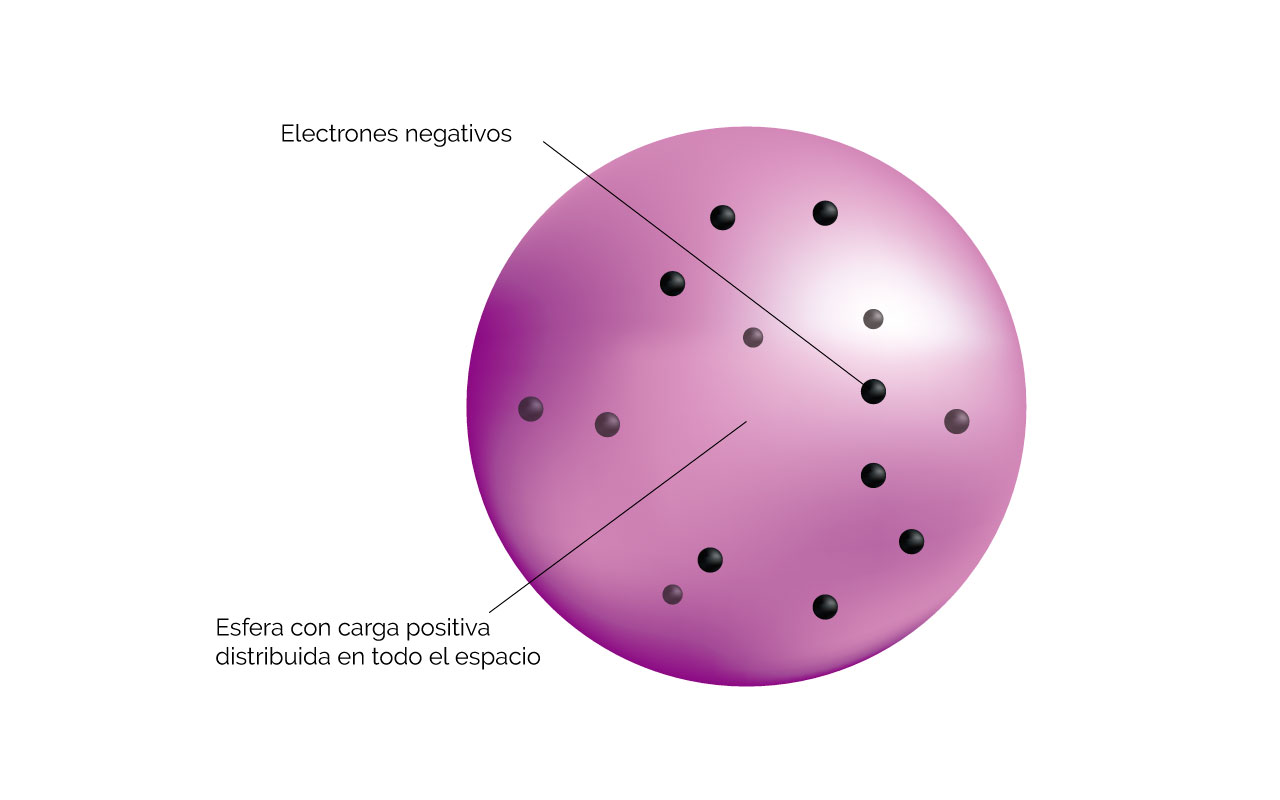
Figura 3. Modelo del pudin de pasas. Tomada y adaptada de Chemistry. The Central Science (9a Ed) por Brown, New Jersey: Pearson, Prentice Hall. Derechos de autor, 2002.
Explicación figura 3. Modelo del átomo de acuerdo con W. Thomson. Él suponía que las únicas partículas cargadas que existían eran los electrones. Estos estarían inmersos en una esfera que tenía la carga positiva distribuida en el volumen.
No obstante, Rutherford, otro investigador, realizó una serie de experimentos en 1911, para dilucidar la estructura atómica. Los experimentos arrojaron como resultado principal, que la mayor parte de la masa del átomo se encuentra confinada en un pequeño volumen (diámetro ∼10-4 Å), al que denominó núcleo atómico. Más tarde otros investigadores determinaron que dicho núcleo atómico se encontraba constituido por protones y neutrones.
El diámetro estimado de un átomo, si se asume forma esférica, está entre 1 y 5 Å, que comparado con el núcleo atómico, resulta ser aproximadamente 105 veces mayor. Esto aclara que la mayor parte del átomo es espacio vacío. Estos resultados desvirtuaron el modelo de Thomson en favor de la verdadera estructura de los átomos.
Además de los experimentos mencionados, otros investigadores realizaron aportes muy valiosos para consolidar nuestra imagen de la estructura de los átomos. Entre estos están los experimentos de J.J. Thomson con los que se determinó la relación carga/masa del electrón y los de Millikan que dieron como resultado la carga de los electrones o partículas negativas más pequeñas en los átomos.