Orbitales atómicos
Un orbital atómico es un subnivel energético orientado que se encuentra en un nivel de energía determinado dentro del átomo y que puede alojar máximo 2 electrones.
Entonces, una combinación particular de n, l y ml define un orbital atómico y este tiene capacidad de alojar dos electrones. Por lo tanto, cada celda puede alojar máximo dos electrones.
A continuación se presentan ejemplos de definición de orbitales atómicos:
Si n = 1 → l = 0(s) → ml = 0 entonces el orbital es 1s02 o simplemente 1s2, donde el superíndice indica que admite máximo 2 electrones.
Es decir, el nivel 1 tiene un solo orbital que admite dos electrones. En consecuencia, el primer nivel de energía puede alojar máximo 2 electrones.
En la tabla periódica el primer nivel es el primer periodo. En este se encuentra el Hidrógeno que tiene un electrón y el Berilio con dos electrones. No hay más elementos en ese periodo y la razón es el número máximo de electrones que pueden alojarse en el nivel. Si revisamos en la tabla periódica la configuración electrónica, distribución electrónica o estructura electrónica de estos dos elementos son:
H 1s1, un electrón en el orbital 1s.
Be 1s2, dos electrones en el orbital 1s.
Entonces, a medida que se aumenta en el número atómico de los elementos se llenan simultáneamente los orbitales con electrones, desde los orbitales con menor energía hasta los orbitales con mayor energía.
En la figura 1 se presentan los orbitales atómicos en notación de celdas o cajas para los niveles energéticos de uno a cinco.
Figura 1. Representación de los orbitales atómicos en celdas o cajas
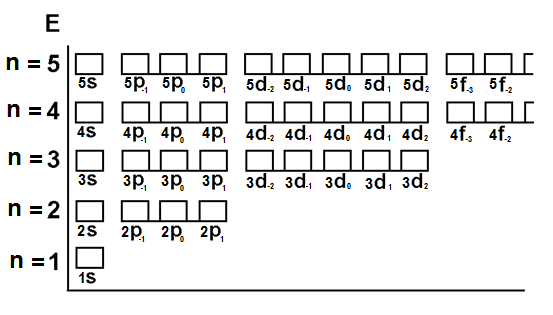
(Para ampliar la imagen haga clic sobre ella)
Hemos revisado la representación de los orbitales atómicos en escalas energéticas. Ahora se revisará la representación gráfica de los orbitales dentro del átomo.
Los orbitales s tienen forma esférica. A mayor número de n mayor tamaño de la esfera. En el siguiente gráfico se presentan las formas para los distintos orbitales s.
Figura 2. Forma de los orbitales s
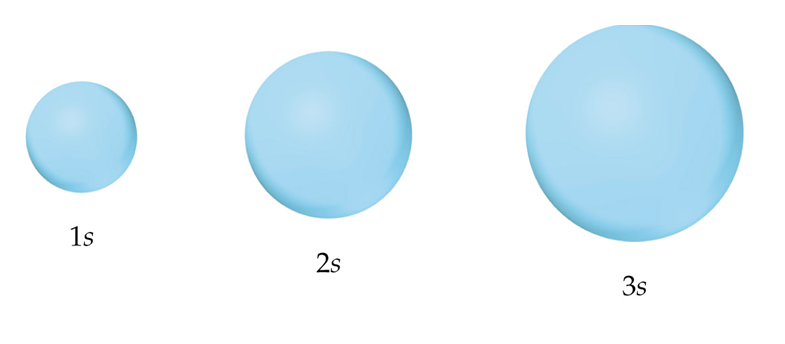
(Para ampliar la imagen haga clic sobre ella)
Cada orbital s tiene una región energética mayor, pero contiene a los otros orbitales s. Los 2s contienen los 1s, los 3s contienen a los 2s y 1s y así sucesivamente.
Los orbitales p, que son tres (p-1, p0 y p1), tienen una forma distinta. Son dos lóbulos energéticos orientados en un eje coordenado de la siguiente manera:
Figura 3.
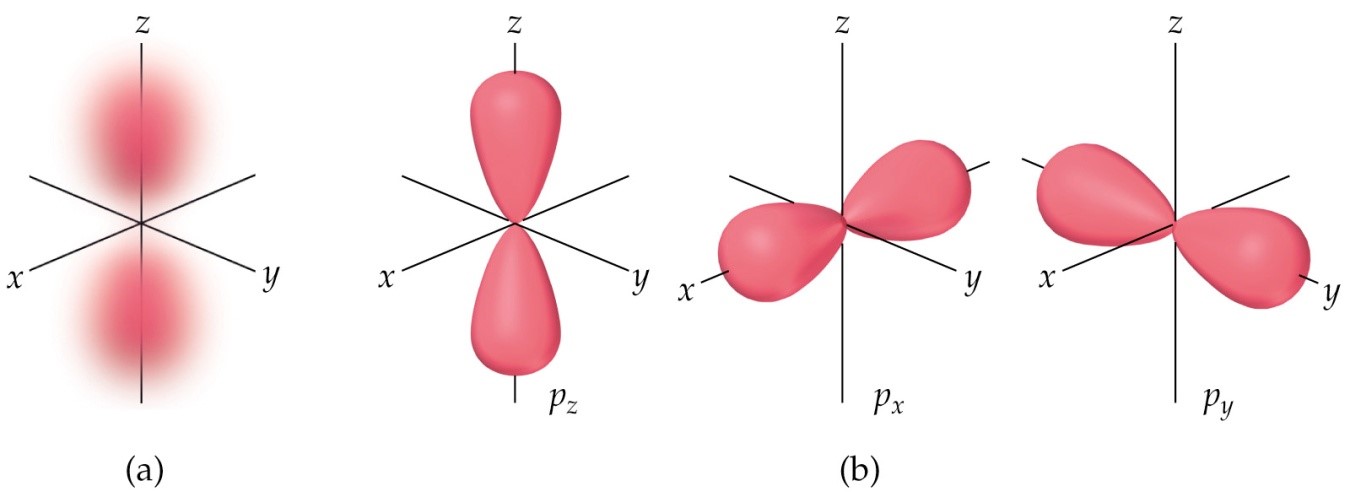
Fuente: Figura 8. Forma de los orbitales pTomada y adaptada de Chemistry. The Central Science (9a Ed) por Brown, New Jersey: Pearson, Prentice Hall. Derechos de autor, 2002.
(Para ampliar la imagen haga clic sobre ella)
Donde,
px = p-1
py = P0
y pz = p1
Aquí los valores de ml -1, 0, 1 de los orbitales se representan por un eje coordenado x, y, z, respectivamente. Los orbitales p de mayor valor de n contienen a los de menor valor de n, tal como ocurre con los orbitales s.
Los orbitales d son cinco (d-2, d-1, d0, d1, d2), las formas de sus regiones energéticas lobulares, se presentan en la figura 4.
Figura 4.
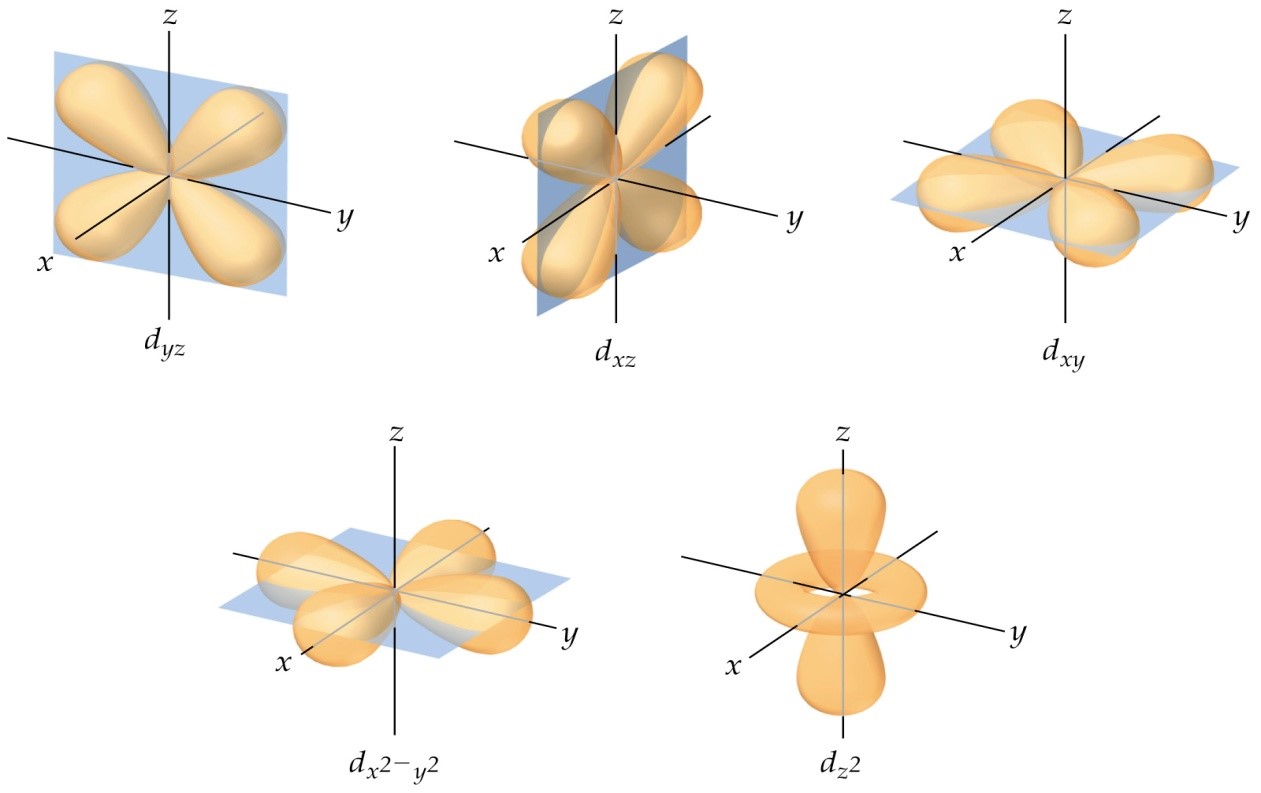
Fuente: Forma de los orbitales d. Tomada y adaptada de Chemistry. The Central Science (9a Ed) por Brown, New Jersey: Pearson, Prentice Hall. Derechos de autor, 2002.
(Para ampliar la imagen haga clic sobre ella)
Donde,
dz2 = d-2
dxz = d-1
dyz = d0
dyy = d1
dx2-y2 = d2
Aquí los valores de ml -2, -1, 0, 1, 2 de los orbitales se representan por una combinación de ejes coordenados z2, xz, yz, xy, x2 – y2 respectivamente. Los orbitales d de mayor valor de n contienen a los de menor valor de n.
A continuación se presenta una gráfica de energía y regiones energéticas para los orbitales de los niveles energéticos 1, 2 y 3.
Figura 5.
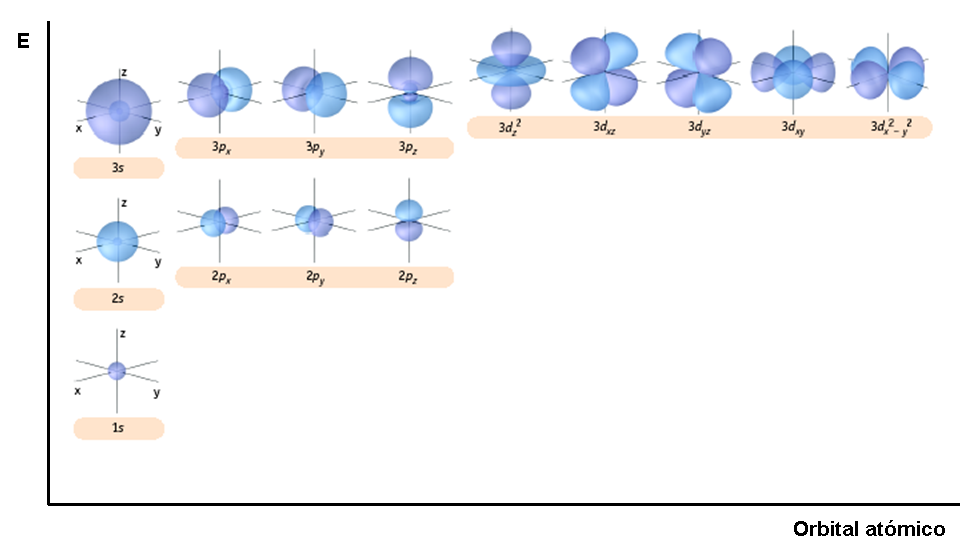
Fuente: Gráfico. Forma de los orbitales y representación en escala de energía. Tomada y adaptada de Chemistry. The Central Science (9a Ed) por Brown, New Jersey: Pearson, Prentice Hall. Derechos de autor, 2002.
(Para ampliar la imagen haga clic sobre ella)
Una vez establecida toda la teoría cuántica de los átomos y determinados los valores energéticos de los orbitales atómicos y sus representaciones, se observó que la energía de los orbitales atómicos de un mismo nivel no tenían el mismo valor.
Por ejemplo para el nivel 4 el orbital 4s presenta menor energía que el 4p, este a su vez menor energía que el 4d y este menor al 4f.
Se puede generalizar para todos los orbitales atómicos de un mismo nivel en un átomo, que organizados energéticamente, quedan: s < p < d < f < g
A partir de estos resultados se obtiene la organización de los orbitales atómicos en los niveles energéticos, que se presenta a continuación:
Figura 6. Escala verdadera de los orbitales atómicos en los niveles de energía

(Para ampliar la imagen haga clic sobre ella)
Se pueden observar anomalías entre los orbitales 3d y 4s, puesto que debería primero llenarse 3d y luego 4s pero ocurre lo contrario. Es tan alta la energía de los orbitales 3d que superan la energía del orbital atómico 4s. Por lo tanto, el orbital 4s se llena primero que el 3d.
Lo mismo ocurre con los orbitales f que tienen mayor energía que los s, p y d y comienzan a llenarse dos niveles después. Por ejemplo, los orbitales 4f comienzan a llenarse después de llenos los orbitales 6s, en el nivel 6, es decir 2 niveles más arriba del nivel donde les correspondería llenarse.
Un orbital se puede caracterizar por los 3 números cuánticos n, l y ml (n, l, ml). Por ejemplo, el orbital atómico (4, 2, 1), en notación de vector, se refiere al orbital con números cuánticos n igual a 4, l igual a 2 y ml igual a 1. La notación spdf de dicho orbital atómico es 4d1, que admite máximo 2 electrones y se localiza en el nivel 5.
